Forfatter:
Lewis Jackson
Opprettelsesdato:
6 Kan 2021
Oppdater Dato:
1 Juli 2024
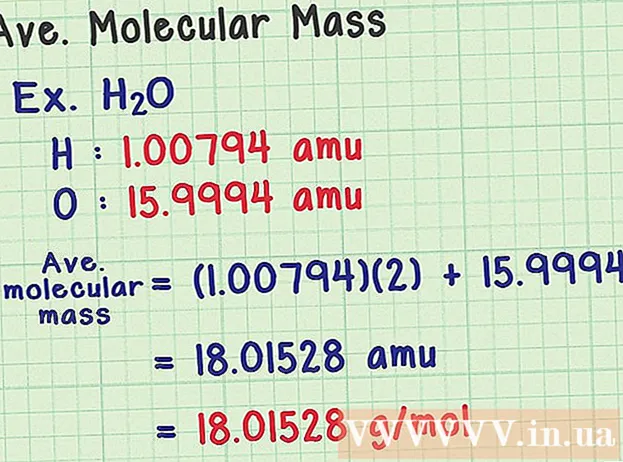
Innhold
Det gjennomsnittlige masseatomet er ikke et direkte mål på massen til et atom. I stedet er dette den gjennomsnittlige massen per atom fra en typisk prøve av elementet. Hvis du kan måle massene av milliarder av individuelle atomer, kan du finne ut av dette ved å beregne gjennomsnittet. Vi har en mer praktisk metode, som er basert på informasjon om de forskjellige isotoper av det kjemiske elementet.
Fremgangsmåte
Del 1 av 2: Beregn gjennomsnittlig masseatom
Forstå isotoper og masseatomer. I naturen eksisterer de fleste elementene i mange former eller isotoper. Den eneste forskjellen mellom to isotoper av det samme elementet er antall nøytroner i atomet, hvis antall nøytroner påvirker masseatomet. Beregning av gjennomsnittlig masseatom tar hensyn til effekten av denne forskjellen, og forteller deg gjennomsnittsmassen for hvert atom i et utvalg av disse atomene.
- For eksempel har sølv (Ag) to naturlige isotoper: Ag-107 og Ag-109 (eller Ag og Ag). Isotopen er oppkalt etter "massetallet", eller summen av antall protoner og antall nøytroner i et atom. Dette betyr at Ag-109 har to flere nøytroner enn Ag-107, så atomet er litt tyngre.

Finn massen til hver isotop. Du trenger to opplysninger for hver isotop. Du kan slå opp i referansebøker eller slå opp på nettet, for eksempel webelements.com. Den første er masseatomet eller atommassen til hver isotop. Isotoper med flere nøytroner har mer masse.- For eksempel har sølvisotopen Ag-107 masseatomet 106.90509 amu (enheten til et kubikkatom). Isotopen Ag-109 er litt tyngre med en masse på 108,90470.
- Paret desimaler på slutten kan være litt forskjellige i dokumentene. Ikke skriv noen tall i parentes etter massen.

Skriv ned den naturlige overlevelsesgraden for hver isotop. Dette forholdet indikerer isotopens utbredelse, som en prosentandel av elementets totale atomer. Du finner denne informasjonen i det samme dokumentet med et kubikkatom på. Naturlig overlevelse av alle isotoper bør være 100% (selv om det kan avvike noe på grunn av feil i avrundingen).- Ag-107 isotopen har forholdet 51,86%. Isotopen Ag-109 er mindre vanlig med en hastighet på 48,14%. Det betyr at en normal sølvprøve har 51,86% Ag-107 og 48,14% Ag-109.
- Eventuelle isotoper som ikke har denne overlevelsesgraden blir ignorert. Disse isotoper finnes ikke naturlig på jorden.

Konverter isotoprosenten til et desimaltall. Del dette forholdet med 100, vil gi samme verdi som et desimal.- I sølvprøven ovenfor er forholdet mellom isotoper 51,86 / 100 = 0,5186 og 48,14 / 100 = 0,4814.
Finn det gjennomsnittlige kubiske atomet. Det gjennomsnittlige masseatomet til et element har n isotoper like (Atomic BlockIsotop 1 * forholdIsotop 1) + (atommasseIsotop 2 * forholdIsotop 2) + ... + (atommasseisotoper n * forholdisotoper n. Dette er et eksempel på "gjennomsnittsmasse", noe som betyr at jo større overlevelsesraten til isotopen er, desto større er effekten på resultatet. Slik bruker du denne formelen for sølv er som følger:
- Medium masse atomAg = (masseatomAg-107 * forholdAg-107) + (atommasseAg-109 * forholdAg-109)
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
= 107,8677 amu. - Finn det elementet i det periodiske systemet for å sjekke resultatene. Det gjennomsnittlige kubiske atomet er alltid skrevet under elementets kjemiske symbol.
- Medium masse atomAg = (masseatomAg-107 * forholdAg-107) + (atommasseAg-109 * forholdAg-109)
Del 2 av 2: Bruke resultater
Konverter masse til atomnummer. Det gjennomsnittlige masseatomet viser forholdet mellom masse og antall atomer i en typisk prøve av dette elementet. Dette er veldig nyttig i kjemiske laboratorier fordi det er nesten umulig å telle atomer nøyaktig, men massene er enkle å bestemme. For eksempel kan du veie en prøve av sølv og vite at det vil være ett sølvatom for hver 107 8667 amu.
Konverter til molær masse. Atommasseenheten er veldig liten, så kjemikere bruker ofte gramenheten til masse. Heldigvis har vi definisjoner av disse konseptene, slik at transformasjonen skal være enkel. Bare multipliser det gjennomsnittlige masseatomet med 1 g / mol (molær massekonstant) for å få et resultat i g / mol. For eksempel inneholder 107 8667 gram sølv en mol sølvatomer.
Finn gjennomsnittlig molekylvekt. Siden et molekyl er en samling av atomer, kan du legge til massen til alle atomer for å finne molekylmassen. Hvis du bruker et gjennomsnittlig masseatom (i stedet for massen til en bestemt isotop), vil resultatet være den gjennomsnittlige molekylmassen til en prøve i naturen. Her er et eksempel:
- Et vannmolekyl har den kjemiske formelen H2O inneholder to hydrogenatomer (H) og et oksygen (O) atom.
- Hydrogen har et gjennomsnittlig masseatom på 1.00794 amu. Oksygen har en gjennomsnittlig atommasse på 15.9994 amu.
- Så den gjennomsnittlige molekylmassen til H2O er lik (1,00794) (2) + 15,9994 = 18,01528 amu, som tilsvarer 18,01528 g / mol.
Råd
- Konseptet med relativ atommasse brukes noen ganger synonymt med et gjennomsnittlig masseatom. Det er en liten forskjell fordi atommassen er relativt un enhet; det er en måling av massen i forhold til et karbon-12-atom. Så lenge du bruker atommassenheten i den gjennomsnittlige kubiske atomberegningen, er disse to verdiene de samme.
- Tallet i parentes etter det kubiske atomet forteller oss feilen. For eksempel betyr masseatom 1.0173 (4) at elementets normale atom har et masseområde på omtrent 1.0173 ± 0.0004. Du trenger ikke å skaffe deg dette nummeret hvis det ikke blir bedt om det.
- På det periodiske systemet er det gjennomsnittlige kubiske atomet for det følgende elementet større enn det før det, med få unntak. Her er en rask måte å sjekke resultatene på.
- 1 atommasseenhet er 1/12 massen til et karbon-12-atom.
- Isotopoverlevelsesraten beregnes i henhold til typiske naturlig forekommende prøver på jorden. Ikke-naturlig forekommende stoffer som meteoritter eller en som produseres i et laboratorium kan ha forskjellige isotopforhold, så det gjennomsnittlige masseatomet er også annerledes.
Advarsel
- Masseatomer skrives alltid i atommasseenheter (amu eller u), noen ganger kalt dalton (Da). Skriv aldri en annen masseenhet (for eksempel et kilo) etter dette tallet uten å endre det.
Hva trenger du
- Blyant
- Papir
- Laptop
- Data om isotopoverlevelsesrate i naturen.
- Masseatomenhetsdata for isotoper.