Forfatter:
Eric Farmer
Opprettelsesdato:
10 Mars 2021
Oppdater Dato:
1 Juli 2024
Innhold
- Trinn
- Metode 1 av 2: Bestemmelse av antall nøytroner i atomer (ikke isotoper)
- Metode 2 av 2: Bestemmelse av antall nøytroner i isotoper
- Tips
I atomer av samme element er antall protoner konstant, mens antall nøytroner kan variere.Ved å vite hvor mange nøytroner et bestemt atom inneholder, kan du avgjøre om det er et vanlig atom eller en isotop som vil ha færre eller flere nøytroner. Å bestemme antall nøytroner i et atom er ganske enkelt. Alt du trenger å gjøre for å beregne antall nøytroner i et atom eller en isotop er å følge instruksjonene våre og holde det periodiske systemet tilgjengelig.
Trinn
Metode 1 av 2: Bestemmelse av antall nøytroner i atomer (ikke isotoper)
 1 Finn elementet i det periodiske bordet. Som et eksempel vil vi vurdere osmium (Os), som er i den sjette perioden (sjette rad fra toppen).
1 Finn elementet i det periodiske bordet. Som et eksempel vil vi vurdere osmium (Os), som er i den sjette perioden (sjette rad fra toppen).  2 Finn atomnummeret til elementet. Dette er som regel det mest merkbare tallet i cellen til et element og er vanligvis plassert over symbolet (i versjonen av det periodiske systemet som vi bruker i vårt eksempel, er det ingen andre tall). Atomnummeret er antall protoner i ett atom av det elementet. For osmium er dette tallet 76, det vil si at det er 76 protoner i ett osmiumatom.
2 Finn atomnummeret til elementet. Dette er som regel det mest merkbare tallet i cellen til et element og er vanligvis plassert over symbolet (i versjonen av det periodiske systemet som vi bruker i vårt eksempel, er det ingen andre tall). Atomnummeret er antall protoner i ett atom av det elementet. For osmium er dette tallet 76, det vil si at det er 76 protoner i ett osmiumatom. - Antall protoner er uendret, og det er dette som gjør et element til et element.
 3 Finn atommassen til et element. Dette tallet er vanligvis funnet under element symbolet. Vær oppmerksom på at atommassen ikke er gitt i versjonen av det periodiske systemet i vårt eksempel (dette er ikke alltid tilfellet; i mange versjoner av det periodiske systemet er atommassen angitt). Atommassen til osmium er 190,23.
3 Finn atommassen til et element. Dette tallet er vanligvis funnet under element symbolet. Vær oppmerksom på at atommassen ikke er gitt i versjonen av det periodiske systemet i vårt eksempel (dette er ikke alltid tilfellet; i mange versjoner av det periodiske systemet er atommassen angitt). Atommassen til osmium er 190,23.  4 Rund atommassen til nærmeste hele tall. I vårt eksempel er 190.23 avrundet til 190.
4 Rund atommassen til nærmeste hele tall. I vårt eksempel er 190.23 avrundet til 190. - Atommasse er gjennomsnittlig antall isotoper av et bestemt element, vanligvis uttrykkes det ikke som et heltall.
 5 Trekk atomnummeret fra atommassen. Siden protoner og nøytroner står for den absolutte delen av atommassen, gir subtrahering av antall protoner (det vil si atomnummer, som er lik antall protoner) fra atommassen antall nøytroner i atomet. Tallene etter desimaltegnet refererer til den svært lille massen av elektroner i et atom. I vårt eksempel: 190 (atomvekt) - 76 (antall protoner) = 114 (antall nøytroner).
5 Trekk atomnummeret fra atommassen. Siden protoner og nøytroner står for den absolutte delen av atommassen, gir subtrahering av antall protoner (det vil si atomnummer, som er lik antall protoner) fra atommassen antall nøytroner i atomet. Tallene etter desimaltegnet refererer til den svært lille massen av elektroner i et atom. I vårt eksempel: 190 (atomvekt) - 76 (antall protoner) = 114 (antall nøytroner).  6 Husk formelen. For å finne antall nøytroner i fremtiden, bare bruk denne formelen:
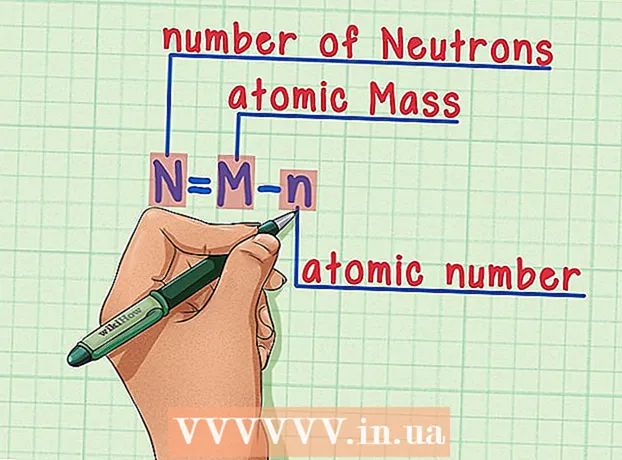
6 Husk formelen. For å finne antall nøytroner i fremtiden, bare bruk denne formelen: - N = M - n
- N = antall nøytroner
- M = atommasse
- n = atomnummer
- N = M - n
Metode 2 av 2: Bestemmelse av antall nøytroner i isotoper
 1 Finn elementet i det periodiske bordet. Som et eksempel vil vi vurdere isotopen til karbon 14C. Siden det ikke-isotopiske karbonet 14C bare er karbon C, finner du karbon på det periodiske bordet (andre periode eller andre rad fra toppen).
1 Finn elementet i det periodiske bordet. Som et eksempel vil vi vurdere isotopen til karbon 14C. Siden det ikke-isotopiske karbonet 14C bare er karbon C, finner du karbon på det periodiske bordet (andre periode eller andre rad fra toppen).  2 Finn atomnummeret til elementet. Dette er som regel det mest merkbare tallet i cellen til et element og er vanligvis plassert over symbolet (i versjonen av det periodiske systemet som vi bruker i vårt eksempel, er det ingen andre tall). Atomnummeret er antall protoner i ett atom av det elementet. Kull er nummer 6, noe som betyr at ett karbon har seks protoner.
2 Finn atomnummeret til elementet. Dette er som regel det mest merkbare tallet i cellen til et element og er vanligvis plassert over symbolet (i versjonen av det periodiske systemet som vi bruker i vårt eksempel, er det ingen andre tall). Atomnummeret er antall protoner i ett atom av det elementet. Kull er nummer 6, noe som betyr at ett karbon har seks protoner.  3 Finn atommassen. Når det gjelder isotoper, er dette veldig enkelt å gjøre, siden de er navngitt i henhold til deres atommasse. I vårt tilfelle har karbon 14C en atommasse på 14. Nå kjenner vi atommassen til isotopen; den påfølgende beregningsprosessen er den samme som for å bestemme antall nøytroner i atomer (ikke isotoper).
3 Finn atommassen. Når det gjelder isotoper, er dette veldig enkelt å gjøre, siden de er navngitt i henhold til deres atommasse. I vårt tilfelle har karbon 14C en atommasse på 14. Nå kjenner vi atommassen til isotopen; den påfølgende beregningsprosessen er den samme som for å bestemme antall nøytroner i atomer (ikke isotoper).  4 Trekk atomnummeret fra atommassen. Siden protoner og nøytroner står for den absolutte delen av atommassen, gir subtrahering av antall protoner (det vil si atomnummer, som er lik antall protoner) fra atommassen antall nøytroner i atomet. I vårt eksempel: 14 (atommasse) - 6 (antall protoner) = 8 (antall nøytroner).
4 Trekk atomnummeret fra atommassen. Siden protoner og nøytroner står for den absolutte delen av atommassen, gir subtrahering av antall protoner (det vil si atomnummer, som er lik antall protoner) fra atommassen antall nøytroner i atomet. I vårt eksempel: 14 (atommasse) - 6 (antall protoner) = 8 (antall nøytroner).  5 Husk formelen. For å finne antall nøytroner i fremtiden, bare bruk denne formelen:
5 Husk formelen. For å finne antall nøytroner i fremtiden, bare bruk denne formelen: - N = M - n
- N = antall nøytroner
- M = atommasse
- n = atomnummer
- N = M - n
Tips
- Protoner og nøytroner utgjør nesten den absolutte massen av grunnstoffer, mens elektroner og andre partikler utgjør en ekstremt ubetydelig masse (denne massen har en tendens til null).Siden ett proton har omtrent samme masse som ett nøytron, og atomnummeret er antall protoner, kan du ganske enkelt trekke antall protoner fra den totale massen.
- Osmium - et metall i fast tilstand ved romtemperatur, har navnet sitt fra det greske ordet "osme" - lukt.
- Hvis du ikke er sikker på hva et tall i det periodiske systemet betyr, husk: tabellen er vanligvis bygget rundt et atomnummer (det vil si antall protoner), som starter ved 1 (hydrogen) og vokser en enhet fra venstre til høyre , slutter med 118 (Oganesson). Dette er fordi antall protoner i et atom bestemmer selve elementet, og et slikt tall er den enkleste måten å organisere elementene på (for eksempel er et atom med 2 protoner alltid helium, akkurat som et atom med 79 protoner alltid er gull ).