Forfatter:
Lewis Jackson
Opprettelsesdato:
8 Kan 2021
Oppdater Dato:
25 Juni 2024

Innhold
Den netto ioniske ligningen er en viktig del av kjemien fordi den kun representerer partiklene som endres i en kjemisk reaksjon. De brukes mest i oksidasjonsreduksjonsreaksjoner, metabolske reaksjoner og nøytraliseringsreaksjoner av syrer - baser. Det er tre grunnleggende trinn for å skrive en netto ionisk ligning: balansere den molekylære ligningen, konvertere den til den full ioniske ligningen (hvordan hvert stoff eksisterer i løsning), og til slutt skrive netto ionisk ligning.
Fremgangsmåte
Del 1 av 2: Forstå komponentene i den ioniske ligningen
Kjenn forskjellen mellom molekyler og ioniske forbindelser. Det første trinnet i å skrive en netto ionisk ligning er å bestemme de ioniske forbindelsene i reaksjonen. Joniske forbindelser er de som dissosierer ioner i en vandig løsning og har en elektrisk ladning. Molekylære forbindelser er forbindelser som aldri har elektrisk ladning. De dannes mellom to ikke-metaller og blir noen ganger referert til som kovalente forbindelser.
- Joniske forbindelser kan dannes mellom metaller og ikke-metaller, metaller og polyatomiske ioner, eller flere polyatomiske ioner.
- Hvis du er usikker på hva forbindelsen er, kan du se etter elementene i forbindelsen i det periodiske systemet.

Anerkjenn løseligheten til en forbindelse. Ikke alle ioniske forbindelser er oppløselige i vandig oppløsning, og kan derfor ikke dissosieres til ioner. Du må identifisere løseligheten til hver forbindelse før du fortsetter med resten av ligningen. Nedenfor er et sammendrag av reglene for løselighet. Finn et løselighets regneark for mer detaljert informasjon og unntak fra disse reglene.- Følg disse reglene i rekkefølgen som er skissert nedenfor:
- Alle Na-, K- og NH-salter4 alle smelter.
- Alle INGEN salter3, C2H3O2, ClO3og ClO4 alle oppløses.
- Alle Ag-, Pb- og Hg-salter2 alle oppløses.
- Alle Cl-, Br- og I-salter er oppløselige.
- Alle CO-salter3, O, S, OH, PO4, CrO4, Cr2O7, og så3 er oppløst (unntatt i noen få tilfeller).
- Alle SO-salter4 er oppløst (unntatt i noen få tilfeller).
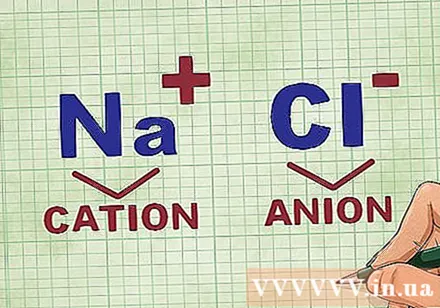
Bestemmelse av kationer og anioner i en forbindelse. Kationer er de positive ionene i en forbindelse og er vanligvis metallet. Anionet er det negative ionet i forbindelsen og er ikke-metallisk. Noen ikke-metaller kan danne kationer, men metaller danner alltid kationer.- For eksempel, i NaCl, er Na det positivt ladede kationen fordi det er et metall, og Cl er det negativt ladede anionet fordi det er ikke-metallisk.

Kjenn igjen polyatomiske ioner i reaksjonen. Polyatomiske ioner er ladede molekyler som er tett bundet sammen og ikke dissosieres under kjemiske reaksjoner. Det er viktig å gjenkjenne polyatomiske ioner fordi de har en spesifikk ladning og ikke dissosierer. Polyatomiske ioner kan ha en positiv eller negativ ladning.- Hvis du studerer generell kjemi, er det ofte nødvendig å huske noen vanlige polyatomiske ioner.
- Noen vanlige polyatomiske ioner er CO3, NEI3, NEI2, SÅ4, SÅ3, ClO4 og ClO3.
- Du kan også finne mange andre ioner i kjemibøker eller på internett.
Del 2 av 2: Skrive en netto ionisk ligning
Balansere molekylære ligninger. Før du skriver en netto ionisk ligning, må du sørge for at molekylligningen er balansert. For å balansere ligningen legger du til koeffisienter foran forbindelsen slik at atomnummeret til hvert element er likt på begge sider av ligningen.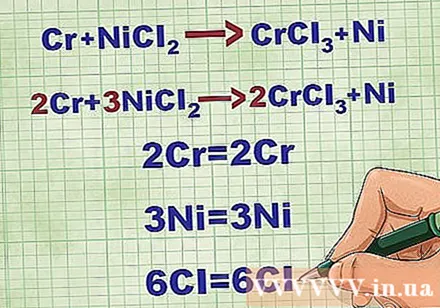
- Skriv antall atomer som utgjør hver forbindelse på begge sider av ligningen.
- Legg til en koeffisient foran andre elementer enn oksygen og hydrogen for å balansere hver side.
- Hydrogenatombalanse.
- Oksygenatombalanse.
- Fortell antall atomer på hver side av ligningen for å sikre at de er balanserte.
- For eksempel Cr + NiCl2 -> CrCl3 + Ni Balansert til 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni.
Identifiser tilstanden til forbindelsen i ligningen. Mange ganger i problemet er det nøkkelord for å fortelle deg tilstanden til hver forbindelse. Det er flere regler som hjelper til med å bestemme tilstanden til et element eller en forbindelse.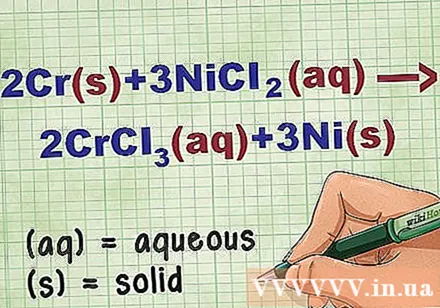
- Hvis ingen tilstand er gitt for elementet, bruk tilstanden som er funnet i det periodiske systemet.
- Hvis forbindelsen kalles en løsning, kan du skrive den som vandig eller (dd).
- Hvis det er vann i ligningen, må du bestemme om den ioniske forbindelsen er vannløselig ved hjelp av oppløselighetstabellen. Hvis løseligheten er høy, vil forbindelsen være vandig (dd), hvis løseligheten er lav, vil forbindelsen være fast (r).
- Uten vann er den ioniske forbindelsen fast (r).
- Hvis problemet er surt eller basisk, er forbindelsen vandig (dd).
- For eksempel 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni. Elementformene Cr og Ni er i fast tilstand. NiCl2 og CrCl3 ioniske forbindelser er oppløselige, så de er vandige. Skriv om ligningen som: 2Cr(r) + 3NiCl2(dd) -> 2CrCl3(dd) + 3Ni(r).
Bestem hvilke forbindelser som vil dissosiere (dissosiere i kationer og anioner) i løsning. Når et stoff eller en forbindelse dissosierer seg, dissosierer den seg i et positivt ladet ion (kation) og et negativt ladet ion (anion). Dette er komponentene som vil bli ekvilibrert på slutten av den netto ioniske ligningen.
- Tørrstoffer, væsker, gasser, molekylære forbindelser, ioniske forbindelser med lav løselighet, polyatomiske ioner og svake syrer vil ikke dissosieres.
- Joniske forbindelser har høy løselighet (bruk løselighetstabellen) og sterke syrer vil ionisere 100% (HCl(dd), HBr(dd), HI(dd), H2SÅ4(dd), HClO4(dd)og HNO3(dd)).
- Merk, selv om polyatomiske ioner ikke skiller seg ut mer, hvis de er bestanddel av den forbindelsen, skiller de seg fra forbindelsen.
Beregn ladningen for hvert ion som er dissosiert fra forbindelsen. Husk at metaller vil danne positive ioner og ikke-metaller vil danne negative ioner. Bruk det periodiske systemet for å bestemme ladningen til et element. Du må også balansere ladningen til hvert ion i forbindelsen.
- I dette eksemplet, NiCl2 dissosiert i Ni og Cl mens CrCl3 delt i Cr og Cl.
- Ni har en ladning på 2+ fordi Cl har en negativ ladning, men har 2 atomer. Derfor må vi balansere de 2 negative Cl-ionene. Cr har en ladning på 3+, så vi må balansere de 3 negative Cl-ionene.
- Husk at polyatomiske ioner har en spesifikk ladning.
Skriv ned den komplette ioniske ligningen. Alt som dissosierer eller ioniserer (sterke syrer) skiller seg i to separate ioner. Stoffets tilstand forblir (dd), men sørg for at ligningen forblir balansert.
- Tørrstoffer, væsker, gasser, svake syrer og ioniske forbindelser med lav oppløselighet endrer ikke tilstand eller skilles i ioner. Vi holder dem intakte.
- Molekylære stoffer vil spre seg i løsning slik at deres tilstand endres til (dd). Tre unntak er ikke bli (dd) er: CH4(k), C3H8(k)og C8H18(l).
- Fortsetter vi med eksemplet ovenfor, ser den fullstendige ioniske ligningen slik ut: 2Cr(r) + 3Ni(dd) + 6Cl(dd) -> 2Cr(dd) + 6Cl(dd) + 3Ni(r). Når Cl ikke er tilstede i en forbindelse, er det ikke en bifasisk substans, så vi multipliserer koeffisienten med antall atomer i forbindelsen for å få 6 Cl-ioner på begge sider av ligningen.
Fjern likevektsionene ved å fjerne de samme ionene på hver side av ligningen. Du kan bare avbryte hvis de er nøyaktig de samme på begge sider (ladning, atomnummer, etc.). Skriv om ligningen uten de ødeleggbare stoffene.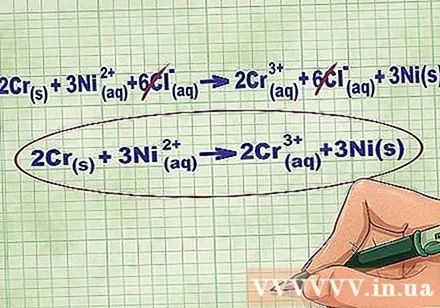
- Etter å ha fullført eksemplet, har vi 6 avbrytbare Cl-likevektsioner på hver side. Den netto ioniske ligningen er 2Cr(r) + 3Ni(dd) -> 2Cr(dd) + 3Ni(r).
- Hvis du har rett, bør den totale ladningen på reaktantsiden være lik den totale ladningen på produktsiden i den netto ioniske ligningen.
Råd
- Skriv tilstandene til alle stoffene i ligningen, hvis ikke deg vil miste poeng.