Forfatter:
Lewis Jackson
Opprettelsesdato:
12 Kan 2021
Oppdater Dato:
1 Juli 2024
Innhold
Å bestemme antall nøytroner i et atom er ganske enkelt, du trenger ikke engang å gjøre noen eksperimenter. For å beregne antall nøytroner i et normalt atom eller en isotop, trenger du bare å ha et periodisk system klart og følge instruksjonene.
Fremgangsmåte
Metode 1 av 2: Finn antall nøytroner i et normalt atom
Bestem elementets posisjon på det periodiske systemet. For eksempel finner vi elementet osmium (Os) i den sjette raden fra toppen.

Finn atomnummeret til elementet. Dette er det mest iøynefallende tallet som går etter hvert element og er over hovedsymbolet (på tavlen vi bruker er det ingen andre tall). Atomnummer er antall protoner i et enkelt atom av dette elementet. Os er tallet 76, noe som betyr at det er 76 protoner i et osmiumatom.- Antallet protoner endres aldri i et element; det er i det vesentlige den definerende egenskapen til et element.

Finn atomvekten til elementet. Dette tallet er vanligvis funnet under hovedsymbolet. Merk at det periodiske systemet i dette eksemplet bare har atomnummer og ingen atomvekt. Ikke alle periodiske tabeller. Osmium har en atomvekt på 190,23.
Rund atomvekten til nærmeste heltall for å få atommassen. For eksempel ville 190,23 bli avrundet til 190, så atommassen til osmium er 190.- Atomvekt er gjennomsnittet av isotoper av det samme kjemiske elementet, og det er derfor det vanligvis ikke er et helt tall.
Trekk atomnummeret fra atommassen. Siden det meste av atommassen er massen av protoner og nøytroner, trekker du antall protoner fra atommassen (dvs. atomnummer) vil du telle få antall nøytroner i atomet. Tallet etter desimaltegnet representerer den svært lille massen av elektroner i atomet. I dette eksemplet har vi: 190 (masseatom) - 76 (antall protoner) = 114 (antall nøytroner).
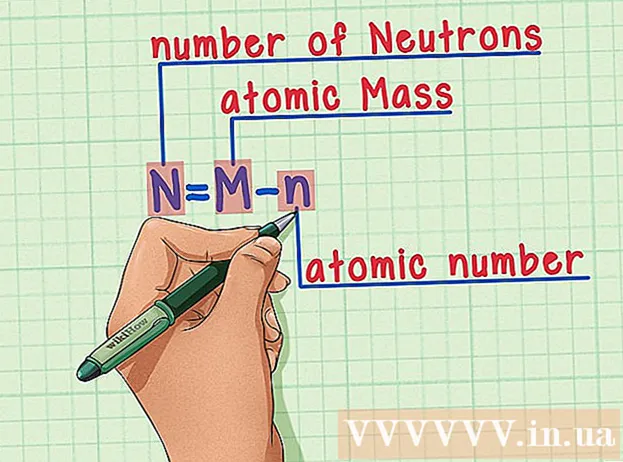
Husk oppskriften utenat. For å finne antall nøytroner bruker vi bare følgende formel:
- N = M - n
- N = antall nøytroner
- M = atommasse
- n = atomnummer
- N = M - n
Metode 2 av 2: Finn antall nøytroner i isotopen
Bestem elementets posisjon på det periodiske systemet. La oss ta elementet karbon-14 isotopen som et eksempel. Siden isotopformen av karbon-14 ganske enkelt er karbon (C), må du se etter karbon i det periodiske systemet (andre rad fra toppen).
Finn atomnummeret til elementet. Dette er det mest iøynefallende tallet som går etter hvert element og er over hovedsymbolet (på tavlen vi bruker er det ingen andre tall). Atomnummer er antall protoner i et enkelt atom av dette elementet. C er nummer 6, noe som betyr at det er 6 protoner i et karbonatom.
Finn atommasse. Dette er ekstremt enkelt med isotoper fordi de er oppkalt etter atommasse. For eksempel vil karbon-14 ha en atommasse på 14. Når du har funnet atommassen til isotopen, vil de gjenværende trinnene for å finne antall nøytroner være det samme som for et normalt atom.
Trekk atomnummeret fra atommassen. Siden det meste av atommassen er massen av protoner og nøytroner, trekker du antall protoner fra atommassen (dvs. atomnummer) vil du telle få antall nøytroner i atomet. Tallet etter desimaltegnet representerer den svært lille massen av elektroner i atomet. I dette eksemplet har vi: 14 (masseatom) - 6 (antall protoner) = 8 (antall nøytroner).
Husk oppskriften utenat. For å finne antall nøytroner bruker vi følgende formel:
- N = M - n
- N = antall nøytroner
- M = atommasse
- n = atomnummer
- N = M - n
Råd
- Massen til et element er i stor grad massen av protoner og nøytroner, mens massene av elektroner og andre elementer er ubetydelige (nær null). Siden massen til protonen er omtrent lik nøytronmassen, og atomnummeret representerer antall protoner, trekker vi ganske enkelt antall protoner fra den totale massen.
- Hvis du ikke husker betydningen av tallene på det periodiske bordet, husk at det periodiske systemet ofte er bygget på atomnummer (dvs. antall protoner), starter ved 1 (hydrogen) og inkrementerer en enhet fra fra venstre til høyre, og slutter med 118 (ununoctium). Siden antall protoner er et identifiserende trekk ved hvert atom, er det den enkleste egenskapen som elementene er arrangert på. (For eksempel er et atom med 2 protoner alltid helium, akkurat som et atom med 79 protoner alltid er gull.)
Kilder og sitater
- Interaktivt periodisk tabell