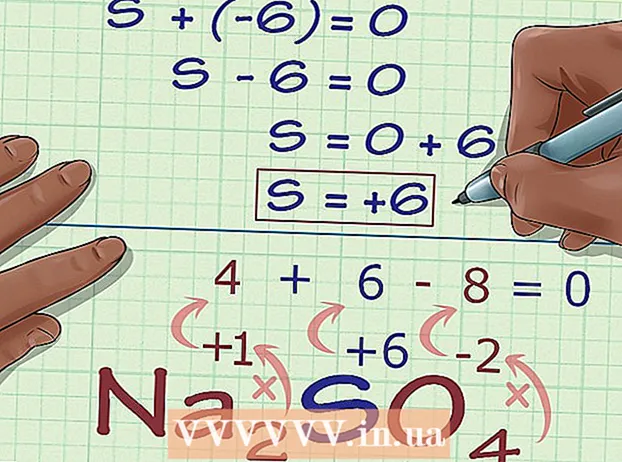
Innhold
- Å trå
- Del 1 av 2: Tilordne oksidasjonsnumre basert på kjemiske regler
- Del 2 av 2: Tilordne tall til atomer uten reglene for oksidasjonsnummer
- Tips
- Nødvendigheter
I kjemi betyr uttrykkene "oksidasjon" og "reduksjon" de reaksjonene der et atom (eller en gruppe av atomer) mister henholdsvis elektroner. Oksidasjonsnumre er tall som er tildelt atomer (eller grupper av atomer) for å hjelpe kjemikere med å kontrollere hvor mange elektroner som er tilgjengelige for å bli forskjøvet, og om gitte reaktanter oksiderer eller reduserer under en reaksjon. Prosessen med å tilordne oksidasjonstall til atomer kan variere fra veldig enkel til mer kompleks, avhengig av ladningen til atomene og den kjemiske sammensetningen av molekylene som de er en del av. For å gjøre ting mer komplisert, kan noen atomer ha flere oksidasjonsnumre. Heldigvis styres tildelingen av oksidasjonsnumre av klart definerte, enkle å følge regler, men en grunnleggende forståelse av kjemi og algebra vil gjøre det enklere å bruke disse reglene.
Å trå
Del 1 av 2: Tilordne oksidasjonsnumre basert på kjemiske regler
 Bestem om stoffet det er snakk om er elementært. Frie, ubundne atomer har alltid et oksidasjonsnummer på 0. Dette gjelder både atomer som består av et enkelt atom og atomer hvis grunnform er diatomisk eller polyatomisk.
Bestem om stoffet det er snakk om er elementært. Frie, ubundne atomer har alltid et oksidasjonsnummer på 0. Dette gjelder både atomer som består av et enkelt atom og atomer hvis grunnform er diatomisk eller polyatomisk. - For eksempel Al(s) og Cl2 begge har oksidasjonsnummeret 0 fordi de ikke er sammensatte atomer.
- Merk at svovel i sin grunnform, S.8 (oktasulfur), selv om det er uregelmessig, har det også et oksidasjonsnummer på 0.
 Bestem om stoffet det er snakk om er et ion. Ioner har oksidasjonstall som er lik ladningen. Dette gjelder både ubundne ioner og ioner som er en del av et sammensatt ion.
Bestem om stoffet det er snakk om er et ion. Ioner har oksidasjonstall som er lik ladningen. Dette gjelder både ubundne ioner og ioner som er en del av et sammensatt ion. - For eksempel har ionet Cl et oksidasjonsnummer på -1.
- Cl-ionet fortsatt har et oksidasjonsnummer på -1 når det er en del av forbindelsen NaCl. Siden Na-ionet per definisjon har en ladning på +1, vet vi at Cl-ionet har en ladning på -1, slik at oksidasjonstallet fortsatt er -1.
 Når det gjelder metallioner, er det godt å huske at flere oksidasjonstall er mulige. Mange metaller kan ha mer enn en landing. For eksempel kan metalljernet (Fe) være et ion med ladning +2 eller +3. ladningen av metallioner (og dermed deres oksidasjonstall) kan bestemmes i forhold til ladningen til de andre atomene i sammensetningen som de er en del av, eller, når de er skrevet som tekst, av notasjonen i romertall (som f.eks. setningen: "Jern (III) ionet har en ladning på +3.").
Når det gjelder metallioner, er det godt å huske at flere oksidasjonstall er mulige. Mange metaller kan ha mer enn en landing. For eksempel kan metalljernet (Fe) være et ion med ladning +2 eller +3. ladningen av metallioner (og dermed deres oksidasjonstall) kan bestemmes i forhold til ladningen til de andre atomene i sammensetningen som de er en del av, eller, når de er skrevet som tekst, av notasjonen i romertall (som f.eks. setningen: "Jern (III) ionet har en ladning på +3."). - La oss for eksempel se nærmere på en forbindelse som inneholder et aluminiumion. Forbindelsen AlCl3 har en ladning på 0. Fordi vi vet at Cl-ioner har en ladning på -1 og 3 Cl-ioner er tilstede i forbindelsen, må Al-ionet ha en ladning på +3, slik at ladningen til alle ionene tilsatt er 0. Så, oksidasjonstallet til Al er +3.
 Tilordne et oksidasjonsnummer -2 til oksygen (med unntak). I nesten i alle tilfeller har oksygenatomer et oksidasjonsnummer på -2. Det er noen få unntak fra denne regelen:
Tilordne et oksidasjonsnummer -2 til oksygen (med unntak). I nesten i alle tilfeller har oksygenatomer et oksidasjonsnummer på -2. Det er noen få unntak fra denne regelen: - Når oksygen er i elementær tilstand (O2), så er oksidasjonstallet lik 0, noe som er tilfelle for alle elementære atomer.
- Når oksygen er en del av peroksid, da er oksidasjonstallet -1. Peroksider er en klasse av forbindelser som har en oksygen-oksygenbinding (eller peroksydanionen O2). For eksempel i molekylet H2O2 (hydrogenperoksid), har oksygen et oksidasjonsnummer (og en ladning) på -1. Når oksygen er en del av et superoksyd, er oksidasjonstallet også -0,5.
- Når oksygen er bundet til fluor, er oksidasjonsnummeret +2. Se fluorregelen nedenfor for mer informasjon. I (O2F.2) dette er +1.
 Tilordne et oksidasjonsnummer på +1 til hydrogen (med unntak). Som med oksygen, avhenger oksidasjonsantallet av hydrogen i unntakstilfeller. Generelt har hydrogen et oksidasjonsnummer +1 (unntatt i grunnform H.2). Men når det gjelder en spesiell forbindelse kalt hybrider, har hydrogen et oksidasjonsnummer på -1.
Tilordne et oksidasjonsnummer på +1 til hydrogen (med unntak). Som med oksygen, avhenger oksidasjonsantallet av hydrogen i unntakstilfeller. Generelt har hydrogen et oksidasjonsnummer +1 (unntatt i grunnform H.2). Men når det gjelder en spesiell forbindelse kalt hybrider, har hydrogen et oksidasjonsnummer på -1. - For eksempel fra H2Å, vi vet at hydrogen har et oksidasjonsnummer på +1 fordi oksygen har en ladning på -2 og vi trenger 2 +1 ladninger for å lage en forbindelse med en total ladning på null. Men med stoffet natriumhydrid, NaH, har hydrogen et oksidasjonsnummer -1 fordi Na-ionet har en ladning på +1, og for å lage den totale ladningen av forbindelsen 0, har hydrogen en ladning (og dermed et oksidasjonsnummer) på -1.
 Fluor alltid et oksidasjonsnummer på -1. Som angitt ovenfor kan oksidasjonsantallene til visse elementer variere på grunn av forskjellige faktorer (metallioner, oksygenatomer i peroksider osv.). Fluor har derimot et oksidasjonsnummer på -1, og det endres aldri. Dette er fordi fluor er det mest elektro-negative elementet, eller med andre ord, det er det elementet som er minst villig til å gi opp elektroner og mest sannsynlig å overta elektroner fra andre atomer. Derfor vil ikke oksidasjonsnummeret endres.
Fluor alltid et oksidasjonsnummer på -1. Som angitt ovenfor kan oksidasjonsantallene til visse elementer variere på grunn av forskjellige faktorer (metallioner, oksygenatomer i peroksider osv.). Fluor har derimot et oksidasjonsnummer på -1, og det endres aldri. Dette er fordi fluor er det mest elektro-negative elementet, eller med andre ord, det er det elementet som er minst villig til å gi opp elektroner og mest sannsynlig å overta elektroner fra andre atomer. Derfor vil ikke oksidasjonsnummeret endres.  Oksydasjonstallene i en forbindelse er lik ladningen til forbindelsen. Oksidasjonstallene til alle atomer i en forbindelse er lik ladningen til den forbindelsen. For eksempel, hvis en forbindelse ikke har noen ladning, vil summen av alle oksidasjonstall være null; hvis forbindelsen er et polyatomisk ion med en ladning på -1, må de tilsatte oksidasjonstallene være -1, etc.
Oksydasjonstallene i en forbindelse er lik ladningen til forbindelsen. Oksidasjonstallene til alle atomer i en forbindelse er lik ladningen til den forbindelsen. For eksempel, hvis en forbindelse ikke har noen ladning, vil summen av alle oksidasjonstall være null; hvis forbindelsen er et polyatomisk ion med en ladning på -1, må de tilsatte oksidasjonstallene være -1, etc. - Dette er en god måte å sjekke svaret på. Hvis det tilsatte oksidasjonsnummeret til en forbindelse ikke tilsvarer ladningen til den forbindelsen, vet du at du har gjort en feil.
Del 2 av 2: Tilordne tall til atomer uten reglene for oksidasjonsnummer
 Finn atomer uten oksidasjonsnummerregler. Noen atomer følger ikke reglene for å finne oksidasjonsnumre. Hvis et atom ikke overholder reglene ovenfor, og du ikke er sikker på hva dets ladning er (for eksempel hvis det er en del av en større forbindelse slik at den enkelte ladning er ukjent), kan du finne oksidasjonsnummeret til atomet ved eliminering. Først bestemmer du hva oksidasjonen er av hvert annet atom i forbindelsen. Deretter løser du summen for det ukjente i ligningen, basert på den totale ladningen av forbindelsen.
Finn atomer uten oksidasjonsnummerregler. Noen atomer følger ikke reglene for å finne oksidasjonsnumre. Hvis et atom ikke overholder reglene ovenfor, og du ikke er sikker på hva dets ladning er (for eksempel hvis det er en del av en større forbindelse slik at den enkelte ladning er ukjent), kan du finne oksidasjonsnummeret til atomet ved eliminering. Først bestemmer du hva oksidasjonen er av hvert annet atom i forbindelsen. Deretter løser du summen for det ukjente i ligningen, basert på den totale ladningen av forbindelsen. - For eksempel i forbindelsen Na2SÅ4, ladningen av svovel (S) er ukjent - den er ikke i sin grunnform, så den er ikke 0, men det er alt vi vet. Dette er en god kandidat for å bruke denne metoden for å bestemme oksidasjonsnummeret algebraisk.
 Bestem de kjente oksidasjonsantallene til de andre elementene i forbindelsen. Ved å bruke tildelingsreglene for oksidasjonsnummer bestemmer vi hvilke oksidasjonsnumre de andre atomene i forbindelsen har. Vær oppmerksom på unntak som O, H, etc.
Bestem de kjente oksidasjonsantallene til de andre elementene i forbindelsen. Ved å bruke tildelingsreglene for oksidasjonsnummer bestemmer vi hvilke oksidasjonsnumre de andre atomene i forbindelsen har. Vær oppmerksom på unntak som O, H, etc. - I Na2SÅ4, vet vi, basert på vårt regelsett, at Na-ionet har en ladning (og dermed et oksidasjonsnummer) på +1 og at oksygenatomer har oksidasjonstall på -2.
 Multipliser antallet av hvert atom med oksidasjonsnummeret. Nå som vi vet oksidasjonstallene til alle atomer unntatt det ukjente, må vi vurdere at noen av disse atomene kan forekomme mer enn en gang. Multipliser hver koeffisient (skrevet i underskrift etter atomets symbol i forbindelsen) med oksidasjonsnummeret.
Multipliser antallet av hvert atom med oksidasjonsnummeret. Nå som vi vet oksidasjonstallene til alle atomer unntatt det ukjente, må vi vurdere at noen av disse atomene kan forekomme mer enn en gang. Multipliser hver koeffisient (skrevet i underskrift etter atomets symbol i forbindelsen) med oksidasjonsnummeret. - Når det gjelder Na2SÅ4, vi vet at det er 2 Na-atomer og 4 O-atomer. Nå gjør vi følgende beregning, 2 × +1, for å få oksidasjonsnummeret til Na, 2, og vi multipliserer 4 × -2, oksidasjonsnummeret til O, -8.
 Legg opp resultatene. Å legge til resultatene av disse multiplikasjonene gir oksidasjonsnummeret til forbindelsen, uten tar hensyn til oksidasjonsnummeret til det ukjente atomet.
Legg opp resultatene. Å legge til resultatene av disse multiplikasjonene gir oksidasjonsnummeret til forbindelsen, uten tar hensyn til oksidasjonsnummeret til det ukjente atomet. - I vårt eksempel med Na2SÅ4, legger vi 2 til -8 for å få -6.
 Beregn det ukjente oksidasjonsnummeret basert på ladningen av forbindelsen. Du har nå alle dataene for å finne det ukjente oksidasjonsnummeret ved hjelp av en enkel algebra. Vi vil bruke en ligning og svaret fra forrige trinn, pluss ladningen av forbindelsen. Med andre ord: (Summen av de ukjente oksidasjonsnumrene) + (det ukjente oksidasjonsnummeret du vil vite) = (ladning av forbindelsen).
Beregn det ukjente oksidasjonsnummeret basert på ladningen av forbindelsen. Du har nå alle dataene for å finne det ukjente oksidasjonsnummeret ved hjelp av en enkel algebra. Vi vil bruke en ligning og svaret fra forrige trinn, pluss ladningen av forbindelsen. Med andre ord: (Summen av de ukjente oksidasjonsnumrene) + (det ukjente oksidasjonsnummeret du vil vite) = (ladning av forbindelsen).- I eksemplet med Na2SÅ4, løser vi dette som følger:
- (Summen av kjente oksidasjonsnumre) + (ukjent oksidasjonsnummer du vil løse) = (ladning av forbindelsen)
- -6 + S = 0
- S = 0 + 6
- S = 6. S har et oksidasjonsnummer eller 6 i Na2SÅ4.
- I eksemplet med Na2SÅ4, løser vi dette som følger:
Tips
- Atomer i grunnform har alltid et oksidasjonsnummer på 0. Et ion som består av 1 atom har et oksidasjonsnummer som er lik ladningen. Gruppe 1A metaller som hydrogen, litium og natrium har et oksidasjonsnummer +1; Gruppe 2A metaller, som magnesium og kalsium, har et oksidasjonsnummer på +2. Både hydrogen og oksygen kan ha to forskjellige oksidasjonstall, avhengig av binding.
- I en forbindelse skal summen av alle oksidasjonstall være lik 0. Hvis det er et ion med 2 atomer, bør summen av oksidasjonstallene være lik ladningen til ionet.
- Det er veldig nyttig å vite hvordan man skal lese det periodiske systemet og hvor man finner metaller og ikke-metaller.
Nødvendigheter
- Periodisk tabell over elementene
- En internettforbindelse
- En kjemibok
- Papir, penn eller blyant
- Kalkulator



