Forfatter:
Sara Rhodes
Opprettelsesdato:
12 Februar 2021
Oppdater Dato:
18 September 2024

Innhold
- Trinn
- Metode 1 av 4: Brusceller
- Metode 2 av 4: Saltvannscelle
- Metode 3 av 4: 14-cellers vannbasert celle
- Metode 4 av 4: Galvanisering ved hjelp av håndflatene
- Tips
Alt du trenger for å lage din egen celle hjemme er to forskjellige metaller, noen ledninger og et ledende medium. Som et ledende medium kan du bruke en rekke materialer for hånden, der du kan senke metall, for eksempel saltvann, sitron eller til og med jord.
Trinn
Metode 1 av 4: Brusceller
 1 Gjør alt du trenger klar. For denne cellen trenger du en uåpnet boks med brus (av noe slag), en plastkopp (180 til 240 milliliter i volum) og en 2 centimeter bred kobberstrimmel som er litt lengre enn glasset. I tillegg trenger du saks, et voltmeter og to ledninger med krokodilleklips i begge ender.
1 Gjør alt du trenger klar. For denne cellen trenger du en uåpnet boks med brus (av noe slag), en plastkopp (180 til 240 milliliter i volum) og en 2 centimeter bred kobberstrimmel som er litt lengre enn glasset. I tillegg trenger du saks, et voltmeter og to ledninger med krokodilleklips i begge ender. - Hvis du ikke har materialet oppført for hånden, kan du kjøpe dem i en jernvarehandel.
- En kobberstripe kan erstattes med kobbertrådstykker som er vridd sammen eller buet i et sikksakkmønster, slik at de har omtrent samme bredde.
 2 Fyll en plastkopp ca 3/4 full med brus. Det er ikke nødvendig å bruke en plastkopp. Det er viktig at den ikke inneholder metall. Et glass laget av ekspandert polystyren eller papir er ganske egnet.
2 Fyll en plastkopp ca 3/4 full med brus. Det er ikke nødvendig å bruke en plastkopp. Det er viktig at den ikke inneholder metall. Et glass laget av ekspandert polystyren eller papir er ganske egnet.  3 Tøm glasset helt. Hvis det fortsatt er brus i boksen, hell (eller drikk) den. Snu boksen over vasken og rist den flere ganger for å tømme all brus.
3 Tøm glasset helt. Hvis det fortsatt er brus i boksen, hell (eller drikk) den. Snu boksen over vasken og rist den flere ganger for å tømme all brus.  4 Skjær en aluminiumslist ut av boksen. Ta en tom krukke og kutt en stripe 2 centimeter bred fra sideveggen. Denne stripen skal være litt lengre enn høyden på plastkoppen, selv om det er greit hvis dette ikke er mulig - i så fall bare brett den øverste kanten av stripen og heng den over glassets kant slik at den synker ned i væske.
4 Skjær en aluminiumslist ut av boksen. Ta en tom krukke og kutt en stripe 2 centimeter bred fra sideveggen. Denne stripen skal være litt lengre enn høyden på plastkoppen, selv om det er greit hvis dette ikke er mulig - i så fall bare brett den øverste kanten av stripen og heng den over glassets kant slik at den synker ned i væske. - Du kan kjøpe en stripe aluminium fra en jernvarehandel for å unngå å kutte boksen.
- Aluminiumsfolie er en dårlig erstatning for en tynn aluminiumsstrimmel. Ikke bruk aluminiumsfolie!
 5 Gni aluminiumslisten med sandpapir (valgfritt). Hvis du kjøpte aluminiumslisten din fra en jernvarehandel, kan du hoppe over dette trinnet hvis. Hvis du klipper en stripe fra en boks, må du slipe den for å fjerne belegget (maling og plast) fra begge sider.
5 Gni aluminiumslisten med sandpapir (valgfritt). Hvis du kjøpte aluminiumslisten din fra en jernvarehandel, kan du hoppe over dette trinnet hvis. Hvis du klipper en stripe fra en boks, må du slipe den for å fjerne belegget (maling og plast) fra begge sider.  6 Dypp strimlene i væsken. Pass på at stripene ikke berører hverandre. Legg dem i et glass ikke side om side, men motsatt hverandre.
6 Dypp strimlene i væsken. Pass på at stripene ikke berører hverandre. Legg dem i et glass ikke side om side, men motsatt hverandre. - Ideelt sett skal kuttstrimlene være lange nok til å stikke ut fra væsken og stige litt over glassets kant.
- Hvis stripene ikke stikker ut over glassets kant, kan du bøye dem litt i den ene enden og henge dem på felgen.
 7 Koble ledningene til metallstrimlene. Ta en ledning, åpne krokodilleklemmen og ta tak i kanten av stripen med den. Deretter kobler du på samme måte den andre ledningen til den andre stripen.
7 Koble ledningene til metallstrimlene. Ta en ledning, åpne krokodilleklemmen og ta tak i kanten av stripen med den. Deretter kobler du på samme måte den andre ledningen til den andre stripen. - Vær forsiktig så du ikke lar klemmene berøre væsken.
- Det spiller ingen rolle hvilken farge ledningen er koblet til en bestemt stripe.
 8 Test den elektrokjemiske cellen. I henhold til instruksjonene som følger med voltmeteret, kobler du ledningene fra hver stripe til instrumentet. Voltmeteret skal vise spenningen over den galvaniske cellen, som vil være omtrent 3/4 volt.
8 Test den elektrokjemiske cellen. I henhold til instruksjonene som følger med voltmeteret, kobler du ledningene fra hver stripe til instrumentet. Voltmeteret skal vise spenningen over den galvaniske cellen, som vil være omtrent 3/4 volt.
Metode 2 av 4: Saltvannscelle
 1 Lagre alt du trenger. For denne typen elektrokjemisk celle trenger du en plastkopp (med et volum på 180 til 240 milliliter), to metallstrimler 2 centimeter brede, litt lengre enn glasset, og en spiseskje (20 gram) salt. Strimlene skal være av forskjellige metaller som sink, aluminium eller kobber. I tillegg trenger du saks, et voltmeter og to ledninger med krokodilleklips i begge ender.
1 Lagre alt du trenger. For denne typen elektrokjemisk celle trenger du en plastkopp (med et volum på 180 til 240 milliliter), to metallstrimler 2 centimeter brede, litt lengre enn glasset, og en spiseskje (20 gram) salt. Strimlene skal være av forskjellige metaller som sink, aluminium eller kobber. I tillegg trenger du saks, et voltmeter og to ledninger med krokodilleklips i begge ender. - I stedet for en spiseskje (20 gram) salt kan du tilsette 1 teskje (7 gram) salt, 1 teskje (5 milliliter) eddik og noen dråper klorblekemiddel i vannet. Hvis du velger dette alternativet, vær forsiktig, da blekemiddel er et farlig kjemikalie.
- Metallstrimler, blytråd og et voltmeter er tilgjengelig i en jernvarehandel. I tillegg selges voltmålere og ledninger i strømforsyningsbutikker.
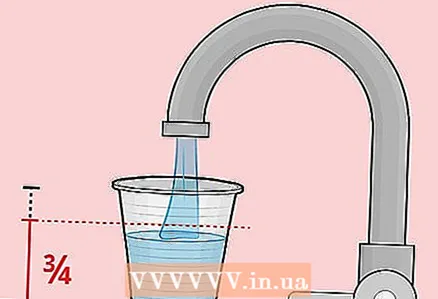 2 Fyll plastkoppen omtrent 3/4 full med vann. Det er ikke nødvendig å bruke en plastkopp.Det er viktig at det er ikke-metallisk, så et glass laget av ekspandert polystyren eller papir vil fungere.
2 Fyll plastkoppen omtrent 3/4 full med vann. Det er ikke nødvendig å bruke en plastkopp.Det er viktig at det er ikke-metallisk, så et glass laget av ekspandert polystyren eller papir vil fungere.  3 Tilsett 1 spiseskje (20 gram) salt i glasset og rør rundt vannet. Gjør det samme hvis du bestemmer deg for å bruke salt, eddik og blekemiddel.
3 Tilsett 1 spiseskje (20 gram) salt i glasset og rør rundt vannet. Gjør det samme hvis du bestemmer deg for å bruke salt, eddik og blekemiddel.  4 Dypp to metallstrimler i glasset. Sørg for at de er nedsenket i vannet og at kantene stikker ut over glassets kant. Hvis stripene er for korte, bretter du kantene og henger dem over glassets kant slik at de blir nedsenket i vannløsningen.
4 Dypp to metallstrimler i glasset. Sørg for at de er nedsenket i vannet og at kantene stikker ut over glassets kant. Hvis stripene er for korte, bretter du kantene og henger dem over glassets kant slik at de blir nedsenket i vannløsningen.  5 Koble ledningene til metallstrimlene. Ta en ledning, åpne krokodilleklemmen og ta tak i kanten av stripen med den. Deretter kobler du på samme måte den andre ledningen til den andre stripen.
5 Koble ledningene til metallstrimlene. Ta en ledning, åpne krokodilleklemmen og ta tak i kanten av stripen med den. Deretter kobler du på samme måte den andre ledningen til den andre stripen. - Vær forsiktig så du ikke lar klemmene berøre væsken.
- Det spiller ingen rolle hvilken farge ledningen er koblet til en bestemt stripe.
 6 Test den elektrokjemiske cellen. I henhold til instruksjonene som følger med voltmeteret, kobler du ledningene fra hver stripe til instrumentet. Voltmeteret skal vise spenningen over den galvaniske cellen, som vil være omtrent 3/4 volt.
6 Test den elektrokjemiske cellen. I henhold til instruksjonene som følger med voltmeteret, kobler du ledningene fra hver stripe til instrumentet. Voltmeteret skal vise spenningen over den galvaniske cellen, som vil være omtrent 3/4 volt.
Metode 3 av 4: 14-cellers vannbasert celle
 1 Lagre alt du trenger. For denne cellen trenger du litt kobbertråd, 15 metallskruer, en isbitbrett og vann. I tillegg trenger du saks, et voltmeter og to ledninger med krokodilleklips i begge ender. Det vil være nødvendig å pakke alle skruene med kobbertråd, bortsett fra en, som vil fungere som en negativ terminal (du vil feste en av ledningene til den etter at du har montert den galvaniske cellen).
1 Lagre alt du trenger. For denne cellen trenger du litt kobbertråd, 15 metallskruer, en isbitbrett og vann. I tillegg trenger du saks, et voltmeter og to ledninger med krokodilleklips i begge ender. Det vil være nødvendig å pakke alle skruene med kobbertråd, bortsett fra en, som vil fungere som en negativ terminal (du vil feste en av ledningene til den etter at du har montert den galvaniske cellen). - Antall skruer avhenger av antall hull i isformen. I vårt eksempel bruker vi en 14-cellers form.
- Skruer laget av annet metall enn kobber kan brukes. Galvaniserte stål- eller aluminiumskruer er egnet. Når det gjelder lengden, bør den være omtrent 2,5 centimeter.
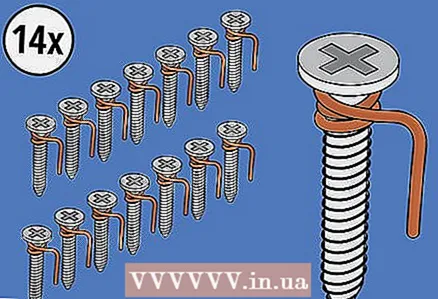 2 Ta 14 skruer og vikle kobbertråd rundt dem. Fest kobbertråd to ganger rundt hver skrue under hodet. Deretter hekles den frie enden av hver ledning. Disse krokene henger skruene på kanten av isbitbrettet.
2 Ta 14 skruer og vikle kobbertråd rundt dem. Fest kobbertråd to ganger rundt hver skrue under hodet. Deretter hekles den frie enden av hver ledning. Disse krokene henger skruene på kanten av isbitbrettet. - Du kan kutte kobbertråden i biter som er lange nok til å vikle rundt skruen (med en liten margin for kroken), eller pakke hver skrue og deretter kutte tråden.
 3 Plasser en skrue i hver spalte på isbitbrettet. Disse vil være individuelle celler i den galvaniske cellen. Heng skruene på kantene på cellene. Sørg for at det bare er en skrue i hvert spor.
3 Plasser en skrue i hver spalte på isbitbrettet. Disse vil være individuelle celler i den galvaniske cellen. Heng skruene på kantene på cellene. Sørg for at det bare er en skrue i hvert spor.  4 Koble de positive og negative ledningene til den ene enden av isbitbrettet. Fest en kobbertrådkrok på utsiden av en av isbitbrettene. Plasser skruen på samme side av skjemaet, men på den tilstøtende cellen. Denne skruen skal stikke over kanten på formen, da du må koble en ledning til den.
4 Koble de positive og negative ledningene til den ene enden av isbitbrettet. Fest en kobbertrådkrok på utsiden av en av isbitbrettene. Plasser skruen på samme side av skjemaet, men på den tilstøtende cellen. Denne skruen skal stikke over kanten på formen, da du må koble en ledning til den.  5 Fyll cellene med vann. Hell nok vann i hver celle slik at messingkrokene og alle skruene er nedsenket.
5 Fyll cellene med vann. Hell nok vann i hver celle slik at messingkrokene og alle skruene er nedsenket.  6 Koble ledningene til de positive og negative terminalene. Ta en ledning og bruk en klemme til å feste den til kobberledningen. Deretter kobler du på samme måte den andre ledningen til skrueterminalen.
6 Koble ledningene til de positive og negative terminalene. Ta en ledning og bruk en klemme til å feste den til kobberledningen. Deretter kobler du på samme måte den andre ledningen til skrueterminalen. - Vær forsiktig så du ikke lar klemmene berøre vannet.
- Det spiller ingen rolle hvilken fargetråd som er koblet til denne eller den pinnen.
 7 Test den elektrokjemiske cellen. Koble ledningenes ledninger til et voltmeter. Et 14 -cellers batteri skal gi omtrent 9 volt.
7 Test den elektrokjemiske cellen. Koble ledningenes ledninger til et voltmeter. Et 14 -cellers batteri skal gi omtrent 9 volt.  8 Øk spenningen. Du kan øke spenningen som genereres av batteriet ved å bruke en løsning av saltvann, eddik, blekemiddel og sitron- eller limesaft som den ledende væsken, eller ved å bruke mer kobbertråd.
8 Øk spenningen. Du kan øke spenningen som genereres av batteriet ved å bruke en løsning av saltvann, eddik, blekemiddel og sitron- eller limesaft som den ledende væsken, eller ved å bruke mer kobbertråd.
Metode 4 av 4: Galvanisering ved hjelp av håndflatene
 1 Gjør alt du trenger klar. For denne cellen trenger du en kobberplate og en aluminiumsplate, hver håndflatestørrelse. I tillegg trenger du et voltmeter og to ledninger med krokodilleklips i begge ender.
1 Gjør alt du trenger klar. For denne cellen trenger du en kobberplate og en aluminiumsplate, hver håndflatestørrelse. I tillegg trenger du et voltmeter og to ledninger med krokodilleklips i begge ender. - Plater, ledninger og et voltmeter er tilgjengelig i en jernvarehandel.
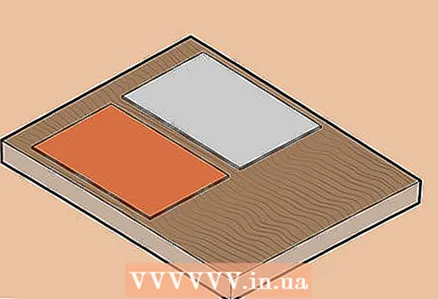 2 Legg aluminiums- og kobberplatene på et trebord. Hvis du ikke har et brett, kan du bruke en flat, ikke-ledende overflate, for eksempel plast.
2 Legg aluminiums- og kobberplatene på et trebord. Hvis du ikke har et brett, kan du bruke en flat, ikke-ledende overflate, for eksempel plast. 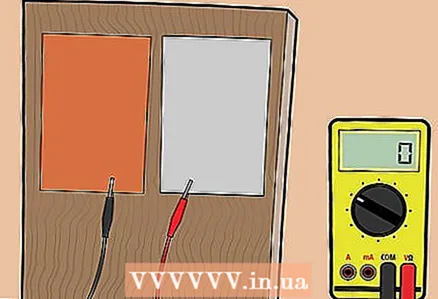 3 Koble platene til voltmeteret. Bruk klemmene til å koble kobberplaten til en og aluminiumsplaten til den andre terminalen på voltmeteret.
3 Koble platene til voltmeteret. Bruk klemmene til å koble kobberplaten til en og aluminiumsplaten til den andre terminalen på voltmeteret. - Hvis du ikke er sikker på hvordan du kobler ledningene til voltmeteret, kan du ta en titt på instruksjonene som fulgte med det.
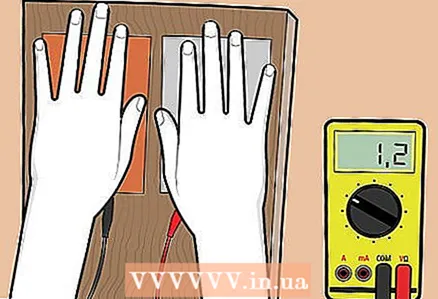 4 Legg håndflaten på hver tallerken. Når du plasserer en håndflate på platene, vil svetten på hendene dine samhandle med metalloverflaten, og voltmeteret vil vise litt spenning.
4 Legg håndflaten på hver tallerken. Når du plasserer en håndflate på platene, vil svetten på hendene dine samhandle med metalloverflaten, og voltmeteret vil vise litt spenning. - Hvis null spenning forblir på voltmeteret, bytt ledninger: koble ledningen fra kobberplaten til terminalen som ledningen fra aluminiumsplaten var koblet til, og omvendt.
- Hvis voltmeteret fremdeles ikke viser noe, sjekk pinnene og ledningene. Hvis alt er i orden med dem, kan platene bli oksidert. Hvis dette skjer, skrubbe dem med et viskelær eller stålull.
Tips
- For å gi et brus- eller saltvannsbatteri mer spenning, ta noen plastkopper, fyll dem med en ledende løsning og dypp metallstrimler i den. Deretter, ved hjelp av ledninger med klips, kobler du stripene av hvert glass til de motsatte stripene i glasset ved siden av - for eksempel bør en kobberlist være koblet til en aluminium.
- Tre eller flere brus- eller saltvannsceller bør være nok til å drive en strømforsyningsenhet, for eksempel en klokke med en LCD-indikator.
- Hvis du vil bruke en galvanisk celle til å drive en enhet, kobler du ledningene til enhetens terminaler i batterirommet. Hvis du ikke kan koble til enheten ved hjelp av krokodilleklipp, trenger du ledninger uten klips. Rådfør deg med en elektriker eller en elektrisk butikk hvis du er i tvil.
- Til sammenligning produserer en standard AAA-celle (lillefingerbatteri) en spenning på 1,1-1,23 volt. En standard AA-celle (finger-type batteri) produserer en spenning på 1,1 til 3,6 volt.
- En galvanisk celle laget av aluminium, kobber og væske skal vare lenge nok (noen hevder at det er flere år), men det er nødvendig å skifte væsken med jevne mellomrom og tørke den lett hver tredje måned (eller oftere med alvorlig korrosjon) kobberplatene med sandpapir.



