Forfatter:
Sara Rhodes
Opprettelsesdato:
12 Februar 2021
Oppdater Dato:
18 September 2024
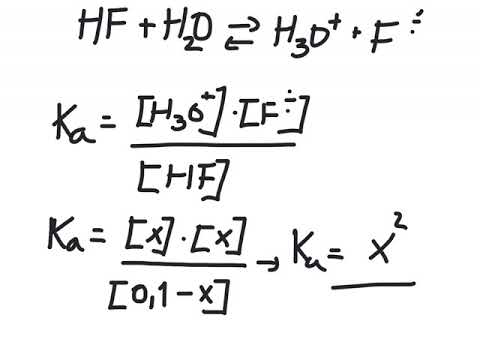
Innhold
- Trinn
- Metode 1 av 3: Hva er pH
- Metode 2 av 3: Beregn pH fra en kjent konsentrasjon
- Metode 3 av 3: Beregn konsentrasjon fra en kjent pH
- Tips
I hverdagen blir pH vanligvis forstått som en skala som brukes til å beskrive nøytraliteten eller omvendt mangelen på nøytralitet av et stoff. I vitenskapelige termer tilsvarer pH -verdien mengden av ioner i en kjemisk løsning. Hvis du studerer kjemi eller beslektede emner, må du kanskje beregne pH -nivået basert på konsentrasjonen av stoffer i løsningen. PH -verdien finnes ved å bruke følgende formel: pH = -lg [H3O].
Trinn
Metode 1 av 3: Hva er pH
 1 Lær om pH. PH -verdien tilsvarer konsentrasjonen av hydrogenioner i løsningen. En løsning med økt konsentrasjon av hydrogenioner kalles sur, og en løsning med redusert konsentrasjon av disse ionene kalles alkalisk. Hydrogenioner er kort betegnet som H. De kan også representeres som en del av en forbindelse, deretter kalles de hydronium og skrives som H30.
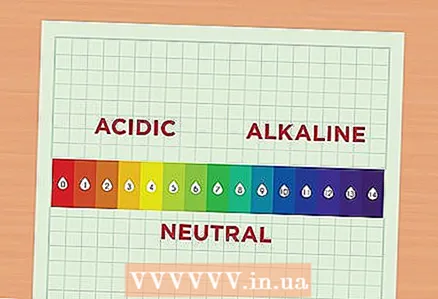
1 Lær om pH. PH -verdien tilsvarer konsentrasjonen av hydrogenioner i løsningen. En løsning med økt konsentrasjon av hydrogenioner kalles sur, og en løsning med redusert konsentrasjon av disse ionene kalles alkalisk. Hydrogenioner er kort betegnet som H. De kan også representeres som en del av en forbindelse, deretter kalles de hydronium og skrives som H30. - Les pH -skalaen. PH -skalaen varierer fra 1 til 14. Jo lavere tallet er, desto surere er løsningen. Motsatt, jo høyere verdi, jo mer alkalisk er løsningen. For eksempel er pH i appelsinjuice 2 fordi denne juicen er en ganske sur væske. Klorblekemiddel har en pH på 12 fordi den inneholder mye alkali. I midten av skalaen er relativt nøytrale løsninger, for eksempel vann, som har en pH på 7.
- En 1-punkts forskjell mellom to løsninger på pH-skalaen betyr at de varierer i surhet med en faktor 10. For eksempel, hvis du tar to løsninger med pH 6 og 7, vil surheten til den første løsningen med pH 6 være 10 ganger høyere enn surheten til den andre løsningen med pH 7. Og for eksempel er surheten til en løsning med en pH på 6 100 ganger høyere enn surheten til en løsning med en pH på 8.
 2 Husk ligningen for å bestemme pH. PH -skalaen beregnes ved hjelp av den negative desimallogaritmen. En negativ desimallogaritme tilsvarer antall nuller foran ett, inkludert null heltall: for eksempel er den negative desimallogaritmen 0,1 1, 0,01 er 2 og så videre. Formelen for å finne pH er som følger: pH = -lg [H3O].
2 Husk ligningen for å bestemme pH. PH -skalaen beregnes ved hjelp av den negative desimallogaritmen. En negativ desimallogaritme tilsvarer antall nuller foran ett, inkludert null heltall: for eksempel er den negative desimallogaritmen 0,1 1, 0,01 er 2 og så videre. Formelen for å finne pH er som følger: pH = -lg [H3O]. - Noen ganger er formelen skrevet som pH = -lg [H]. Det spiller ingen rolle om ligningen H3O eller H, begge er likeverdige.
- Det er ikke nødvendig å kunne beregne desimallogaritmen for å finne pH, siden nesten alle vitenskapelige eller tekniske kalkulatorer har muligheten til å beregne den.
 3 Lær om konsentrasjon. Konsentrasjonen av et stoff tilsvarer antall partikler av dette stoffet som er tilstede i løsningen. Som regel uttrykkes konsentrasjonen i antall mol per volumenhet og betegnes som m / V eller M. I kjemiske laboratorier er konsentrasjonen av løsninger skrevet på flaskene med dem. Hvis du løser et kjemisk problem, kan konsentrasjonen oppgis i tilstanden, eller den må bli funnet.
3 Lær om konsentrasjon. Konsentrasjonen av et stoff tilsvarer antall partikler av dette stoffet som er tilstede i løsningen. Som regel uttrykkes konsentrasjonen i antall mol per volumenhet og betegnes som m / V eller M. I kjemiske laboratorier er konsentrasjonen av løsninger skrevet på flaskene med dem. Hvis du løser et kjemisk problem, kan konsentrasjonen oppgis i tilstanden, eller den må bli funnet.
Metode 2 av 3: Beregn pH fra en kjent konsentrasjon
 1 Husk formelen for å finne pH. Her er formelen: pH = -lg [H3O]. Sørg for at du er kjent med alle elementene som utgjør denne formelen. Se hvilken verdi som tilsvarer konsentrasjon.
1 Husk formelen for å finne pH. Her er formelen: pH = -lg [H3O]. Sørg for at du er kjent med alle elementene som utgjør denne formelen. Se hvilken verdi som tilsvarer konsentrasjon. - I kjemi betyr firkantede parenteser konsentrasjonen av noe.Så formelen for beregning av pH lyder "pH er lik den negative logaritmen til hydroniumionkonsentrasjonen."
 2 Bestem den faktiske konsentrasjonen. Les problemformuleringen nøye. Finn konsentrasjonen av syre eller alkali i kildedataene. Skriv ned den komplette formelen på et stykke papir, og sett inn de kjente verdiene i den. For å unngå forvirring må du alltid angi måleenheter ved siden av tall.
2 Bestem den faktiske konsentrasjonen. Les problemformuleringen nøye. Finn konsentrasjonen av syre eller alkali i kildedataene. Skriv ned den komplette formelen på et stykke papir, og sett inn de kjente verdiene i den. For å unngå forvirring må du alltid angi måleenheter ved siden av tall. - For eksempel, hvis konsentrasjonen er 1,05 x 10 M, skriver du formelen for å beregne pH som følger: pH = -lg [1,05 x 10 M]
 3 Beregn pH. Det er praktisk å bruke en vitenskapelig kalkulator for dette. Skriv først inn minustegnet ved å trykke på "+/-" -knappen. Trykk deretter på "logg" -knappen som tilsvarer desimallogaritmen (på engelsk kalles desimallogaritmen log). Skjermen viser "-logg". Trykk deretter på venstre brakett og angi konsentrasjonen. Ikke glem å angi gradverdien om nødvendig. Lukk deretter brakettene. Som et resultat vil du se “-logg (1.05x10) på kalkulatorskjermen. Klikk "=". Du bør ha en pH -verdi på omtrent 4,98.
3 Beregn pH. Det er praktisk å bruke en vitenskapelig kalkulator for dette. Skriv først inn minustegnet ved å trykke på "+/-" -knappen. Trykk deretter på "logg" -knappen som tilsvarer desimallogaritmen (på engelsk kalles desimallogaritmen log). Skjermen viser "-logg". Trykk deretter på venstre brakett og angi konsentrasjonen. Ikke glem å angi gradverdien om nødvendig. Lukk deretter brakettene. Som et resultat vil du se “-logg (1.05x10) på kalkulatorskjermen. Klikk "=". Du bør ha en pH -verdi på omtrent 4,98.
Metode 3 av 3: Beregn konsentrasjon fra en kjent pH
 1 Bestem hva som er gitt og hva du vil finne. Skriv ned formelen for å beregne pH. Finn deretter ut de kjente verdiene ved å skrive ut verdiene under formelen. For eksempel, hvis du vet at pH -verdien din er 10,1, skriver du dette tallet under pH i formelen.
1 Bestem hva som er gitt og hva du vil finne. Skriv ned formelen for å beregne pH. Finn deretter ut de kjente verdiene ved å skrive ut verdiene under formelen. For eksempel, hvis du vet at pH -verdien din er 10,1, skriver du dette tallet under pH i formelen.  2 Konverter formelen. I dette tilfellet trenger du kunnskap fra skolens algebra -kurs. For å beregne konsentrasjonen fra en kjent pH -verdi, er det nødvendig å transformere formelen slik at konsentrasjonen skiller seg fra hver side av ligningen. Det vil si at det er nødvendig at på den ene siden av likhetstegnet er det et uttrykk som inneholder pH -verdien, og på den andre - konsentrasjonen av hydronium. Først multipliserer du begge sider av ligningen med -1. Hev deretter 10 til makten på hver side av den resulterende likheten.
2 Konverter formelen. I dette tilfellet trenger du kunnskap fra skolens algebra -kurs. For å beregne konsentrasjonen fra en kjent pH -verdi, er det nødvendig å transformere formelen slik at konsentrasjonen skiller seg fra hver side av ligningen. Det vil si at det er nødvendig at på den ene siden av likhetstegnet er det et uttrykk som inneholder pH -verdien, og på den andre - konsentrasjonen av hydronium. Først multipliserer du begge sider av ligningen med -1. Hev deretter 10 til makten på hver side av den resulterende likheten. - Konvertering av likhet pH = -log [H3O], får vi formelen + [H3O] = 10, det vil si at ionekonsentrasjonen er ti til -pH -effekten. Nå, i stedet for pH, erstatter vi en kjent verdi, i vårt tilfelle 10.1.
 3 Løs ligningen. Det er en spesifikk prosedyre for å øke ti til en effekt i kalkulatoren. Skriv først 10. Trykk deretter på eksponentieringstasten. Skriv inn et minustegn og en gradverdi. Klikk "=".
3 Løs ligningen. Det er en spesifikk prosedyre for å øke ti til en effekt i kalkulatoren. Skriv først 10. Trykk deretter på eksponentieringstasten. Skriv inn et minustegn og en gradverdi. Klikk "=". - I vårt eksempel er pH 10,1. Slå "10" og trykk på "EXP" -tasten. Trykk deretter på "- / +", og endre skiltet. Til slutt skriver du inn pH -verdien "10,1" og trykker på "=" -tasten. Som et resultat bør du ende opp med 1e-100. Dette betyr at konsentrasjonen er 1,00 x 10 M.
 4 Vurder svaret du mottok. Gjør det fysisk mening? Hvis pH er 10,1, betyr det at konsentrasjonen av hydronium er ekstremt lav og du har en alkalisk løsning. Dermed tilsvarer den funnet svært lave konsentrasjonen
4 Vurder svaret du mottok. Gjør det fysisk mening? Hvis pH er 10,1, betyr det at konsentrasjonen av hydronium er ekstremt lav og du har en alkalisk løsning. Dermed tilsvarer den funnet svært lave konsentrasjonen
Tips
- Hvis det først er vanskelig å beregne pH -nivået ditt, må du huske på at det er mange kilder for å lære mer om emnet. Bruk en lærebok i kjemi eller be en lærer hjelpe deg.



