Forfatter:
Bobbie Johnson
Opprettelsesdato:
10 April 2021
Oppdater Dato:
1 Juli 2024

Innhold
Vannspaltningsprosess (H2O) i dets bestanddeler (hydrogen og oksygen) ved bruk av elektrisitet kalles elektrolyse. Gassene oppnådd som følge av elektrolyse kan brukes alene - for eksempel fungerer hydrogen som en av de reneste energikildene. Selv om navnet på denne prosessen kan høres litt smart ut, er det faktisk lettere enn det kan virke hvis du har riktig utstyr, kunnskap og litt erfaring.
Trinn
Del 1 av 2: Forbered utstyret
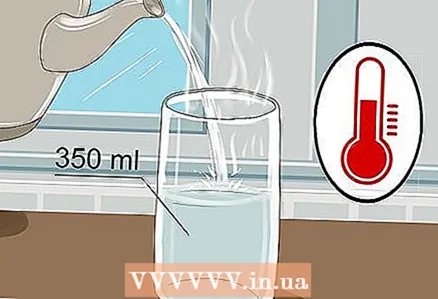 1 Ta et 350 ml glass og hell varmt vann i det. Det er ikke nødvendig å fylle glasset til randen, bare litt vann er nok. Kaldt vann vil gjøre det, selv om varmt vann leder strøm bedre.
1 Ta et 350 ml glass og hell varmt vann i det. Det er ikke nødvendig å fylle glasset til randen, bare litt vann er nok. Kaldt vann vil gjøre det, selv om varmt vann leder strøm bedre. - Både vann fra springen og flaskevann vil gjøre det.
- Varmt vann har en lavere viskositet, noe som gjør det lettere for ioner å bevege seg rundt.
 2 Løs opp 1 ss (20 gram) bordsalt i vann. Hell salt i et glass og rør i vannet for å oppløses. Dette vil skape en saltløsning.
2 Løs opp 1 ss (20 gram) bordsalt i vann. Hell salt i et glass og rør i vannet for å oppløses. Dette vil skape en saltløsning. - Natriumklorid (dvs. bordsalt) er en elektrolytt som øker vannets elektriske ledningsevne. I seg selv leder ikke vann godt strøm.
- Etter at du har økt vannets elektriske ledningsevne, vil strømmen som skapes av batteriet lettere passere gjennom løsningen og effektivt bryte ned molekylene til hydrogen og oksygen.
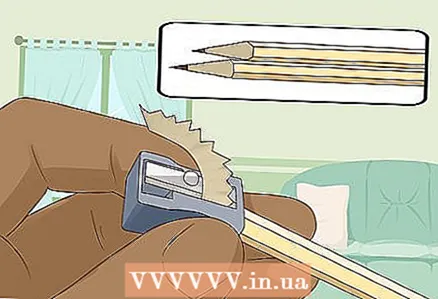 3 Slip to hard-myke blyanter i begge ender for å avsløre ledningen. Ikke glem å fjerne viskelæret fra blyantene. En grafittstang skal stikke ut i begge ender.
3 Slip to hard-myke blyanter i begge ender for å avsløre ledningen. Ikke glem å fjerne viskelæret fra blyantene. En grafittstang skal stikke ut i begge ender. - Grafittstavene fungerer som isolerte elektroder som du kobler batteriet til.
- Grafitt er godt egnet for dette eksperimentet fordi det ikke oppløses eller korroderer i vann.
 4 Skjær ut et pappark som er stort nok til å ligge på glasset. Bruk et ganske tykt stykke papp som ikke vil falle etter at du har stanset to hull i det. Skjær et firkantet stykke ut av en skokasse eller lignende.
4 Skjær ut et pappark som er stort nok til å ligge på glasset. Bruk et ganske tykt stykke papp som ikke vil falle etter at du har stanset to hull i det. Skjær et firkantet stykke ut av en skokasse eller lignende. - Kartongen brukes til å holde blyantene i vannet slik at de ikke berører glassets sider og bunn.
- Kartong er ikke-ledende, så du kan trygt legge det på et glass.
 5 Bruk blyanter til å stikke to hull i papp. Stikk hull i pappa med blyanter - i dette tilfellet blir de tett klemt og glir ikke. Pass på at grafitten ikke berører sidene eller bunnen av glasset, ellers vil det forstyrre eksperimentet.
5 Bruk blyanter til å stikke to hull i papp. Stikk hull i pappa med blyanter - i dette tilfellet blir de tett klemt og glir ikke. Pass på at grafitten ikke berører sidene eller bunnen av glasset, ellers vil det forstyrre eksperimentet.
Del 2 av 2: Gjør et eksperiment
 1 Koble en ledning med krokodilleklips til hver batteripol. Batteriet vil tjene som kilde til elektrisk strøm, og gjennom ledningene med klemmer og grafittstenger vil strømmen nå vannet.Koble den ene ledningen med en klemme til den positive og den andre til den negative polen på batteriet.
1 Koble en ledning med krokodilleklips til hver batteripol. Batteriet vil tjene som kilde til elektrisk strøm, og gjennom ledningene med klemmer og grafittstenger vil strømmen nå vannet.Koble den ene ledningen med en klemme til den positive og den andre til den negative polen på batteriet. - Bruk et 6 volt batteri. Hvis du ikke har et, kan du bruke et 9-volts batteri i stedet.
- Et passende batteri kan fås fra en strømforsyningsbutikk eller et supermarked.
 2 Koble de andre endene av ledningene til blyantene. Fest metalltrådklemmene godt til grafittstavene. Du må kanskje skrelle av mer tre fra blyantene for å unngå at klippene glir av grafittstavene.
2 Koble de andre endene av ledningene til blyantene. Fest metalltrådklemmene godt til grafittstavene. Du må kanskje skrelle av mer tre fra blyantene for å unngå at klippene glir av grafittstavene. - Dermed vil du lukke kretsen, og strøm fra batteriet vil strømme gjennom vannet.
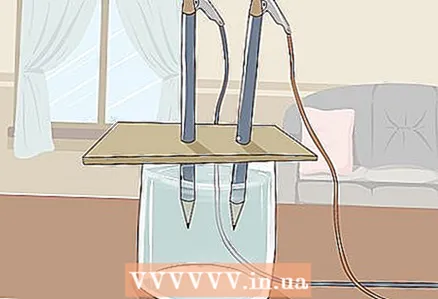 3 Legg kartongen på glasset slik at blyantenes frie ender senkes i vannet. Kartongen skal være stor nok til å hvile på glasset. Vær forsiktig så du ikke forstyrrer riktig plassering av blyantene.
3 Legg kartongen på glasset slik at blyantenes frie ender senkes i vannet. Kartongen skal være stor nok til å hvile på glasset. Vær forsiktig så du ikke forstyrrer riktig plassering av blyantene. - For at eksperimentet skal lykkes, må grafitten ikke berøre veggene og bunnen av glasset. Kontroller dette igjen og juster blyantene om nødvendig.
 4 Se vannet dele seg i hydrogen og oksygen. Gassbobler vil begynne å stige fra grafittstavene som er nedsenket i vannet. Disse er hydrogen og oksygen. Hydrogen frigjøres ved den negative polen og oksygen ved den positive polen.
4 Se vannet dele seg i hydrogen og oksygen. Gassbobler vil begynne å stige fra grafittstavene som er nedsenket i vannet. Disse er hydrogen og oksygen. Hydrogen frigjøres ved den negative polen og oksygen ved den positive polen. - Så snart du kobler ledningene til batteriet og grafittstavene, vil en elektrisk strøm strømme gjennom vannet.
- Flere gassbobler vil dannes på blyanten som er koblet til den negative polen, siden hvert vannmolekyl består av to hydrogenatomer og ett oksygenatom.
Tips
- Hvis du ikke har blyanter med grafittskaft, kan du bruke to små ledninger i stedet. Bare vikle den ene enden av hver ledning rundt den tilsvarende batteripolen og dypp den andre i vannet. Resultatet blir det samme som med blyanter.
- Prøv å bruke et annet batteri. Mengden strøm som strømmer avhenger av batteriets spenning, noe som igjen påvirker splittelsen av vannmolekyler.
Advarsler
- Hvis du tilsetter en elektrolytt, for eksempel salt, til vannet, må du huske på at eksperimentet vil generere en liten mengde av et biprodukt som klor. Det er trygt i så små mengder, men du kan lukte en liten klorlukt.
- Utfør dette eksperimentet under voksen tilsyn. Det er forbundet med elektrisitet og gasser og kan derfor være farlig, men usannsynlig.
Hva trenger du
- To hard-myke blyanter
- Ett 6 eller 9 volt batteri
- Glass med et volum på 350 milliliter
- 2 ledninger med krokodilleklips
- Sliper til blyant
- Salt