Forfatter:
Florence Bailey
Opprettelsesdato:
21 Mars 2021
Oppdater Dato:
1 Juli 2024

Innhold
- Trinn
- Metode 1 av 2: Distribusjon av elektroner ved bruk av det periodiske systemet til D. I. Mendeleev
- Metode 2 av 2: Bruke ADOMAH periodiske system
- Tips
Elektronisk konfigurasjon et atom er en numerisk representasjon av dets elektronorbitaler. Elektroniske orbitaler er områder av forskjellige former som ligger rundt en atomkjerne der et elektron er matematisk sannsynlig. Elektronisk konfigurasjon hjelper til med å fortelle leseren raskt og enkelt hvor mange elektronorbitaler et atom har, samt bestemme antall elektroner i hver orbital. Etter å ha lest denne artikkelen, vil du ha mestret metoden for å generere elektroniske konfigurasjoner.
Trinn
Metode 1 av 2: Distribusjon av elektroner ved bruk av det periodiske systemet til D. I. Mendeleev
 1 Finn atomnummeret til atomet ditt. Hvert atom har et bestemt antall elektroner knyttet til det. Finn symbolet for atomet ditt i det periodiske systemet. Et atomnummer er et positivt heltall som starter med 1 (for hydrogen) og øker med ett for hvert påfølgende atom. Et atomnummer er antall protoner i et atom, og derfor er det også antall elektroner i et atom med null ladning.
1 Finn atomnummeret til atomet ditt. Hvert atom har et bestemt antall elektroner knyttet til det. Finn symbolet for atomet ditt i det periodiske systemet. Et atomnummer er et positivt heltall som starter med 1 (for hydrogen) og øker med ett for hvert påfølgende atom. Et atomnummer er antall protoner i et atom, og derfor er det også antall elektroner i et atom med null ladning. - 2 Bestem ladningen til et atom. Nøytrale atomer vil ha samme antall elektroner som vist i det periodiske systemet. Imidlertid vil ladede atomer ha flere eller færre elektroner, avhengig av mengden ladning. Hvis du arbeider med et ladet atom, kan du legge til eller trekke fra elektroner som følger: legg til et elektron for hver negativ ladning og trekk fra et for hver positiv.
- For eksempel vil et natriumatom med en ladning på -1 ha et ekstra elektron i tillegg til basen atomnummer 11. Med andre ord vil det totale atomet ha 12 elektroner.
- Hvis vi snakker om et natriumatom med en ladning på +1, må ett elektron trekkes fra det grunnleggende atomnummeret 11. Dermed vil atomet ha 10 elektroner.
- 3 Husk den grunnleggende listen over orbitaler. Etter hvert som antallet elektroner øker, fyller de de forskjellige undernivåene til atomets elektronskall i henhold til en bestemt sekvens. Hvert undernivå av elektronskallet, når det er fylt, inneholder et jevnt antall elektroner. Følgende undernivåer er tilgjengelige:
- s-undernivå (ethvert tall i den elektroniske konfigurasjonen som kommer før bokstaven "s") inneholder en enkelt bane, og, i henhold til Paulis prinsipp, kan en orbital inneholde maksimalt 2 elektroner, derfor kan det være 2 elektroner på hvert s-undernivå av elektronskallet.
- p-undernivå inneholder 3 orbitaler, og kan derfor inneholde maksimalt 6 elektroner.
- d-undernivå inneholder 5 orbitaler, så den kan ha opptil 10 elektroner.
- f-undernivå inneholder 7 orbitaler, så den kan ha opptil 14 elektroner.
- g-, h-, i- og k-undernivåer er teoretiske. Atomer som inneholder elektroner i disse orbitalene er ukjente. G-sub-nivået inneholder 9 orbitaler, så teoretisk sett kan det ha 18 elektroner. H-undernivået kan ha 11 orbitaler og maksimalt 22 elektroner; i -sub -nivå -13 orbitaler og maksimalt 26 elektroner; i k -undernivå - 15 orbitaler og maksimalt 30 elektroner.
- Husk ordenenes rekkefølge ved hjelp av det mnemoniske trikset:
Sober Physikere Dpå T Find Giraffes Hiding Jegn Kklør (edru fysikere finner ikke sjiraffer som gjemmer seg på kjøkken).
- 4 Forstå den elektroniske konfigurasjonsposten. Elektroniske konfigurasjoner er registrert for å gjenspeile antall elektroner i hver orbital. Orbitaler skrives sekvensielt, og antallet atomer i hver orbital er overskrift til høyre for orbitalnavnet. Den fullførte elektroniske konfigurasjonen har form av en sekvens av undernivåbetegnelser og overskrift.
- For eksempel den enkleste elektroniske konfigurasjonen: 1s 2s 2p. Denne konfigurasjonen viser at det er to elektroner på 1s -undernivået, to elektroner på 2s -undernivået og seks elektroner på 2p -undernivået. 2 + 2 + 6 = 10 elektroner totalt. Dette er den elektroniske konfigurasjonen av et nøytralt neonatom (neonatomnummer er 10).
- 5 Husk rekkefølgen på orbitalene. Husk at elektronorbitalene er nummerert i stigende rekkefølge av elektronskallnummeret, men i stigende rekkefølge av energi. For eksempel er en fylt 4s -orbital mindre energisk (eller mindre mobil) enn en delvis fylt eller fylt 3d, så 4s -banen blir registrert først. Når du kjenner orbitalenes rekkefølge, kan du enkelt fylle dem ut i henhold til antall elektroner i atomet. Rekkefølgen for å fylle orbitalene er som følger: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- Den elektroniske konfigurasjonen av et atom der alle orbitaler er fylt vil ha følgende form: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Legg merke til at oppføringen ovenfor, når alle orbitaler er fylt, er den elektroniske konfigurasjonen til elementet Uuo (ununoctium) 118, det høyest nummererte atomet i det periodiske systemet. Derfor inneholder denne elektroniske konfigurasjonen alle nåværende kjente elektroniske undernivåer til et nøytralt ladet atom.
- 6 Fyll ut orbitalene i henhold til antall elektroner i atomet ditt. For eksempel, hvis vi vil skrive ned den elektroniske konfigurasjonen til et nøytralt kalsiumatom, må vi starte med å lete etter atomnummeret i det periodiske systemet. Atomnummeret er 20, så vi vil skrive konfigurasjonen av et atom med 20 elektroner i henhold til ovennevnte rekkefølge.
- Fyll ut orbitalene i rekkefølgen ovenfor til du når det tjuende elektronet. Den første 1s -orbitalen vil inneholde to elektroner, 2s -orbitalene vil også ha to, 2p - seks, 3s - to, 3p - 6 og 4s - 2 (2 + 2 + 6 +2 + 6 + 2 = 20.) I med andre ord, den elektroniske konfigurasjonen av kalsium er: 1s 2s 2p 3s 3p 4s.
- Vær oppmerksom på at orbitalene er i stigende rekkefølge av energi. For eksempel, når du er klar til å gå til 4. energinivå, må du først skrive ned 4s -banen og deretter 3d. Etter det fjerde energinivået går du til det femte, der samme rekkefølge gjentas. Dette skjer først etter det tredje energinivået.
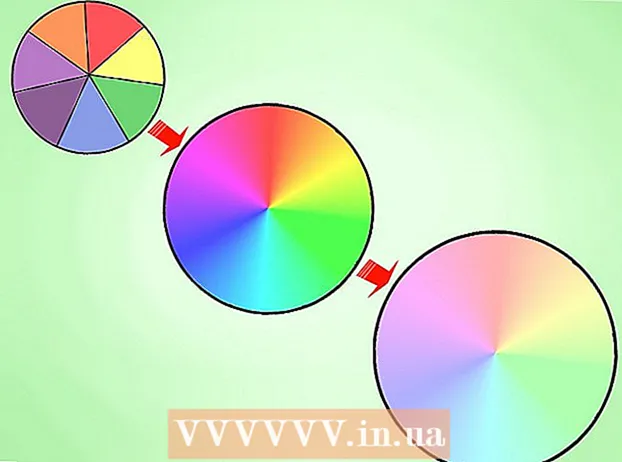
- 7 Bruk det periodiske systemet som en visuell ledetråd. Du har sikkert allerede lagt merke til at formen på det periodiske systemet tilsvarer rekkefølgen på elektroniske undernivåer i elektroniske konfigurasjoner. For eksempel ender atomene i den andre kolonnen fra venstre alltid med "s", mens atomene på høyre kant av den tynne midtseksjonen alltid ender med "d", og så videre. Bruk det periodiske bordet som en visuell guide for å skrive konfigurasjoner - ettersom rekkefølgen du legger til orbitaler tilsvarer din posisjon i tabellen. Se nedenfor:
- Spesielt inneholder de to kolonnene lengst til venstre atomer hvis elektroniske konfigurasjoner ender i s-orbitaler, den høyre blokken i tabellen inneholder atomer hvis konfigurasjoner ender i p-orbitaler, og i den nedre delen atomer ender i f-orbitaler.
- Når du for eksempel skriver ned den elektroniske konfigurasjonen av klor, tenker du slik: "Dette atomet er plassert i den tredje raden (eller" perioden ") i det periodiske systemet. Det er også plassert i den femte gruppen av p -orbitalklossen av det periodiske systemet. Derfor vil den elektroniske konfigurasjonen ende i .3p
- Vær oppmerksom på at elementene i d- og f -orbitalene i tabellen er preget av energinivåer som ikke tilsvarer perioden de befinner seg i. For eksempel tilsvarer den første raden i blokken av elementer med d-orbitaler 3d-orbitaler, selv om den ligger i den fjerde perioden, og den første raden med elementer med f-orbitaler tilsvarer 4f-banen, til tross for at den er er i 6. periode.
- 8 Lær stenografi for å skrive lange elektroniske konfigurasjoner. Atomer på høyre kant av det periodiske systemet kalles edle gasser. Disse elementene er kjemisk veldig stabile. For å forkorte prosessen med å skrive lange elektroniske konfigurasjoner, skriver du bare i firkantet parentes det kjemiske symbolet på den nærmeste edelgassen med færre elektroner enn atomet ditt, og fortsetter deretter å skrive den elektroniske konfigurasjonen av påfølgende orbitalnivåer. Se nedenfor:
- For å forstå dette konseptet er det nyttig å skrive en eksempelkonfigurasjon. La oss skrive konfigurasjonen for sink (atomnummer 30) ved hjelp av edelgass -forkortelsen. Den komplette sinkonfigurasjonen ser slik ut: 1s 2s 2p 3s 3p 4s 3d. Imidlertid ser vi at 1s 2s 2p 3s 3p er den elektroniske konfigurasjonen av argon, en edel gass. Bare erstatt den elektroniske konfigurasjonsdelen av sink med det kjemiske symbolet argon i firkantede parenteser ([Ar].)
- Så den elektroniske konfigurasjonen av sink, skrevet i en forkortet form, er: [Ar] 4s 3d.
- Vær oppmerksom på at hvis du skriver den elektroniske konfigurasjonen av en edelgass, si argon, kan du ikke skrive [Ar]! Man må bruke reduksjonen av edelgassen som vender mot dette elementet; for argon vil det være neon ([Ne]).
Metode 2 av 2: Bruke ADOMAH periodiske system
 1 Lær det periodiske systemet ADOMAH. Denne metoden for å registrere den elektroniske konfigurasjonen krever ikke memorering, men den krever en revidert periodisk tabell, siden i det tradisjonelle periodiske systemet, fra den fjerde perioden, tilsvarer periodetallet ikke elektronskallet. Finn ADOMAH Periodic Table - en spesiell type periodisk tabell utviklet av forsker Valery Zimmerman. Det er lett å finne det med et kort søk på Internett.
1 Lær det periodiske systemet ADOMAH. Denne metoden for å registrere den elektroniske konfigurasjonen krever ikke memorering, men den krever en revidert periodisk tabell, siden i det tradisjonelle periodiske systemet, fra den fjerde perioden, tilsvarer periodetallet ikke elektronskallet. Finn ADOMAH Periodic Table - en spesiell type periodisk tabell utviklet av forsker Valery Zimmerman. Det er lett å finne det med et kort søk på Internett. - I det periodiske systemet til ADOMAH representerer horisontale rader grupper av elementer som halogener, edelgasser, alkalimetaller, jordalkalimetaller, etc. Vertikale kolonner tilsvarer elektroniske nivåer, og såkalte "kaskader" (diagonale linjer som forbinder blokker s, p, d og f) tilsvarer perioder.
- Helium flyttes til hydrogen ettersom begge disse elementene har en 1s -bane. Periodeblokker (s, p, d og f) vises på høyre side, og nivånumre vises nederst. Elementene er vist i bokser nummerert 1 til 120. Disse tallene er vanlige atomnummer som representerer det totale antallet elektroner i et nøytralt atom.
- 2 Finn ditt atom i ADOMAH -tabellen. For å registrere den elektroniske konfigurasjonen av et element, finn symbolet i ADOMAHs periodiske system og kryss av alle elementene med et høyere atomnummer. For eksempel, hvis du trenger å skrive ned den elektroniske konfigurasjonen til erbium (68), krysser du av alle elementene fra 69 til 120.
- Legg merke til tallene 1 til 8 nederst i tabellen. Dette er elektroniske nivånumre eller kolonnetall. Ignorer kolonner som bare inneholder kryssede elementer.For erbium forblir kolonnene nummerert 1, 2, 3, 4, 5 og 6.
- 3 Tell de orbitale undernivåene til elementet ditt. Ser du på blokksymbolene vist til høyre for tabellen (s, p, d og f) og kolonnetallene vist nederst, ignorerer du de diagonale linjene mellom blokkene og bryter kolonnene i kolonneblokker i rekkefølge fra bunnen til toppen. Igjen, ignorer boksene med alle elementene krysset. Skriv ned kolonneblokkene, begynn med kolonnetallet etterfulgt av bloksymbolet, således: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (for erbium).
- Merk: Den elektroniske konfigurasjonen ovenfor Er er skrevet i stigende rekkefølge av det elektroniske undernivånummeret. Det kan også skrives i rekkefølgen for å fylle orbitalene. For å gjøre dette, følg kaskadene nedenfra og opp, ikke kolonnene når du skriver kolonneblokkene: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- 4 Tell elektronene for hvert elektronisk undernivå. Tell elementene i hver blokk-kolonne som ikke var krysset, fest ett elektron fra hvert element, og skriv nummeret ved siden av blokk-symbolet for hver blokk-kolonne som følger: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s ... I vårt eksempel er dette den elektroniske konfigurasjonen av erbium.
- 5 Vurder feil elektroniske konfigurasjoner. Det er atten typiske unntak knyttet til de elektroniske konfigurasjonene av atomer i laveste energitilstand, også kalt grunnenergistatus. De følger ikke hovedregelen bare i de to eller tre siste posisjonene okkupert av elektroner. I dette tilfellet antar den faktiske elektroniske konfigurasjonen at elektronene er i en tilstand med lavere energi sammenlignet med atomkonfigurasjonen. Unntaksatomer inkluderer:
- Cr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); Mo (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); Gd (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); Ac (..., 6d1, 7s2); Th (..., 6d2, 7s2); Pa (..., 5f2, 6d1, 7s2); U (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) og Cm (..., 5f7, 6d1, 7s2).
Tips
- For å finne atomnummeret til et atom når det er skrevet i elektronisk konfigurasjon, legger du bare sammen alle tallene som følger bokstavene (s, p, d og f). Dette fungerer bare for nøytrale atomer, hvis du har å gjøre med et ion, så vil ingenting fungere - du må legge til eller trekke fra antall ekstra eller tapte elektroner.
- Nummeret etter bokstaven er en overskrift, ikke gjør en feil i sjekken.
- Det er ingen "stabilitet i et halvfylt" undernivå. Dette er en forenkling. Enhver stabilitet knyttet til de "halvfylte" undernivåene skyldes det faktum at hver orbital er opptatt av ett elektron, så frastøtningen mellom elektronene minimeres.
- Hvert atom har en stabil tilstand, og de mest stabile konfigurasjonene har fylt undernivåer s og p (s2 og p6). Edelgasser har en slik konfigurasjon, derfor kommer de sjelden i reaksjoner og er plassert til høyre i det periodiske systemet. Derfor, hvis konfigurasjonen ender på 3p, trenger den to elektroner for å nå en stabil tilstand (for å miste seks, inkludert elektroner på s-undernivået, kreves mer energi, så det er lettere å miste fire). Og hvis konfigurasjonen ender på 4d, må den miste tre elektroner for å nå en stabil tilstand. I tillegg er halvfylte undernivåer (s1, p3, d5 ..) mer stabile enn for eksempel p4 eller p2; Imidlertid vil s2 og p6 være enda mer robuste.
- Når du har å gjøre med et ion, betyr dette at antall protoner ikke er lik antallet elektroner. I dette tilfellet vil ladningen til et atom vises øverst til høyre (som regel) i det kjemiske symbolet. Derfor har et antimonatom med en ladning på +2 den elektroniske konfigurasjonen 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p. Vær oppmerksom på at 5p har endret seg til 5p. Vær forsiktig når konfigurasjonen av et nøytralt atom havner på andre undernivåer enn s og s. Når du plukker opp elektroner, kan du bare plukke dem opp fra valensorbitalene (s og p orbitaler).Derfor, hvis konfigurasjonen ender på 4s 3d og atomet får en +2 ladning, vil konfigurasjonen ende på 4s 3d. Vær oppmerksom på at 3d ikke endringer, i stedet for å miste s-orbitalelektroner.
- Det er forhold når elektronet blir tvunget til å "gå til et høyere energinivå." Når et undernivå mangler ett elektron til halv eller full fylling, tar du ett elektron fra nærmeste s- eller p-undernivå og flytter det til undernivået som trenger et elektron.
- Det er to alternativer for registrering av en elektronisk konfigurasjon. De kan skrives i stigende rekkefølge av energinivå -tall eller i rekkefølge for fylling av elektronorbitaler, som vist ovenfor for erbium.
- Du kan også skrive ned den elektroniske konfigurasjonen av et element ved å skrive ned bare valensekonfigurasjonen, som er de siste s- og p -undernivåene. Således vil valenskonfigurasjonen av antimon ha formen 5s 5p.
- Jonah er ikke det samme. Det er mye vanskeligere med dem. Hopp over to nivåer og følg samme mønster avhengig av hvor du begynte og hvor stort antall elektroner er.