Forfatter:
Morris Wright
Opprettelsesdato:
26 April 2021
Oppdater Dato:
14 Kan 2024
Innhold
- Å trå
- Metode 1 av 2: Finne antall nøytroner i et atom
- Metode 2 av 2: Finne antall nøytroner i en isotop
- Tips
Å bestemme antall nøytroner i et atom er veldig enkelt, og du trenger ikke engang å gjøre et eksperiment. For å beregne antall nøytroner i et atom eller en isotop, følg bare disse instruksjonene.
Å trå
Metode 1 av 2: Finne antall nøytroner i et atom
 Slå opp elementet på det periodiske systemet. I dette eksemplet ser vi på Osmium (Os), i rad 6.
Slå opp elementet på det periodiske systemet. I dette eksemplet ser vi på Osmium (Os), i rad 6.  Finn atomnummeret til elementet. Dette er vanligvis tallet over elementets symbol. (I tabellen vi bruker er dette det eneste tallet.) Atomtallet er antall protoner i ett atom av det elementet. Os har nummer 76, noe som betyr at et atom av Osmium har 76 protoner.
Finn atomnummeret til elementet. Dette er vanligvis tallet over elementets symbol. (I tabellen vi bruker er dette det eneste tallet.) Atomtallet er antall protoner i ett atom av det elementet. Os har nummer 76, noe som betyr at et atom av Osmium har 76 protoner.  Finn atommassen til elementet. Dette er vanligvis tallet under elementets symbol. (Dette er ikke nevnt i tabellen vi bruker). Osmium har en atommasse på 190,23.
Finn atommassen til elementet. Dette er vanligvis tallet under elementets symbol. (Dette er ikke nevnt i tabellen vi bruker). Osmium har en atommasse på 190,23.  Rund atommasse til nærmeste hele tall for å finne atommasse. I vårt eksempel blir 190.23 deretter avrundet til 190, noe som resulterer i en atommasse på 190 for Osmium.
Rund atommasse til nærmeste hele tall for å finne atommasse. I vårt eksempel blir 190.23 deretter avrundet til 190, noe som resulterer i en atommasse på 190 for Osmium.  Trekk atomnummeret fra atommassen. Siden det meste av vekten av et atom er okkupert av dets protoner og nøytroner, vil det å trekke antall protoner (f.eks. Atomnummer) fra atommassen gi antall nøytroner i atomet. Tallene etter desimaltegnet representerer det veldig lave masse av elektroner i atomet. I vårt eksempel er dette: 190 (atommasse) - 76 (antall protoner) = 114 (antall nøytroner).
Trekk atomnummeret fra atommassen. Siden det meste av vekten av et atom er okkupert av dets protoner og nøytroner, vil det å trekke antall protoner (f.eks. Atomnummer) fra atommassen gi antall nøytroner i atomet. Tallene etter desimaltegnet representerer det veldig lave masse av elektroner i atomet. I vårt eksempel er dette: 190 (atommasse) - 76 (antall protoner) = 114 (antall nøytroner).  Husk formelen. For å finne antall nøytroner i fremtiden, bruk følgende formel:
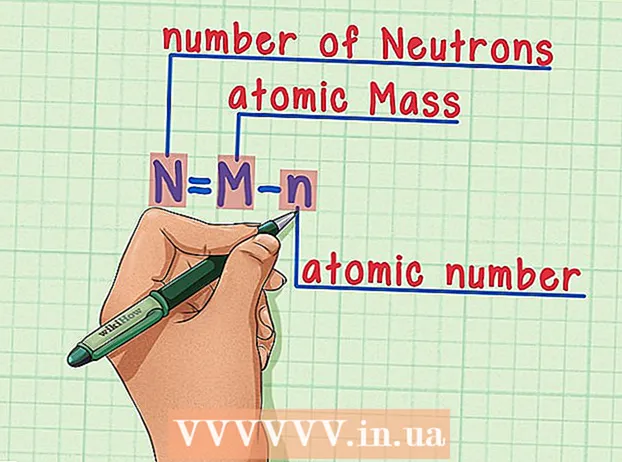
Husk formelen. For å finne antall nøytroner i fremtiden, bruk følgende formel: - N = M - n
- N = antall N.eutroner
- M = atom M.assa
- n = atom nummer
- N = M - n
Metode 2 av 2: Finne antall nøytroner i en isotop
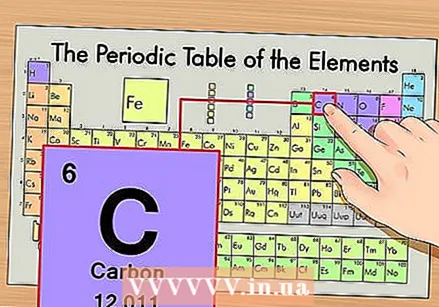 Slå opp elementet på det periodiske systemet. Som et eksempel ser vi på Carbon-14 isotopen. Siden karbon-14 er en isotop av karbon (C), prøv å finne karbon i det periodiske systemet (i andre rad).
Slå opp elementet på det periodiske systemet. Som et eksempel ser vi på Carbon-14 isotopen. Siden karbon-14 er en isotop av karbon (C), prøv å finne karbon i det periodiske systemet (i andre rad).  Finn atomnummeret til elementet. Dette er vanligvis tallet over elementets symbol. (I tabellen vi bruker er dette det eneste tallet.) Atomtallet er antall protoner i ett atom av det elementet. C er nummer 6, noe som betyr at ett karbonatom har 6 protoner.
Finn atomnummeret til elementet. Dette er vanligvis tallet over elementets symbol. (I tabellen vi bruker er dette det eneste tallet.) Atomtallet er antall protoner i ett atom av det elementet. C er nummer 6, noe som betyr at ett karbonatom har 6 protoner.  Finn atommassen. Dette er veldig enkelt med isotoper, fordi navnet deres kommer fra atommassen. Karbon-14 har for eksempel en atommasse på 14. Nå som du kjenner atommassen, tilsvarer hele prosessen å finne antall nøytroner i et vanlig atom.
Finn atommassen. Dette er veldig enkelt med isotoper, fordi navnet deres kommer fra atommassen. Karbon-14 har for eksempel en atommasse på 14. Nå som du kjenner atommassen, tilsvarer hele prosessen å finne antall nøytroner i et vanlig atom.  Trekk atomnummeret fra atommassen. Siden det meste av vekten av et atom er okkupert av protonene og nøytronene, vil det å trekke antall protoner (dvs. atomnummeret) fra atommassen gi antall nøytroner i atomet. I vårt eksempel er dette: 14 (atommasse) - 6 (antall protoner) = 8 (antall nøytroner).
Trekk atomnummeret fra atommassen. Siden det meste av vekten av et atom er okkupert av protonene og nøytronene, vil det å trekke antall protoner (dvs. atomnummeret) fra atommassen gi antall nøytroner i atomet. I vårt eksempel er dette: 14 (atommasse) - 6 (antall protoner) = 8 (antall nøytroner). 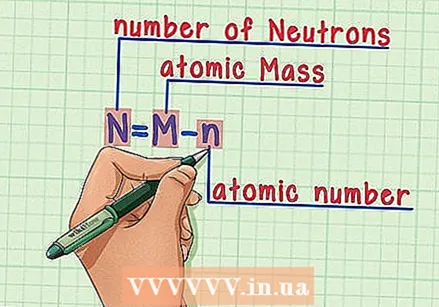 Husk formelen. For å finne antall nøytroner i fremtiden, bruk bare følgende formel:
Husk formelen. For å finne antall nøytroner i fremtiden, bruk bare følgende formel: - N = M - n
- N = antall N.eutroner
- M = atom M.assa
- n = atom nummer
- N = M - n
Tips
- Osmium, et metall som er solid ved romtemperatur, får navnet sitt fra det greske ordet for lukt, "osme".
- Hvis du noen gang er usikker på hva et bestemt tall står for i det periodiske systemet, må du huske at bordet vanligvis er bygget rundt atomnummeret (antall protoner), som starter ved 1 av hydrogen og går opp til 118 (Ununoctium). Dette er fordi antall protoner i et atom bestemmer atomet, noe som gjør det til den foretrukne egenskapen til et element for klar klassifisering. (f.eks. er et atom med 2 protoner alltid helium, akkurat som et atom med 79 protoner alltid er gull.)