Forfatter:
Helen Garcia
Opprettelsesdato:
17 April 2021
Oppdater Dato:
1 Juli 2024
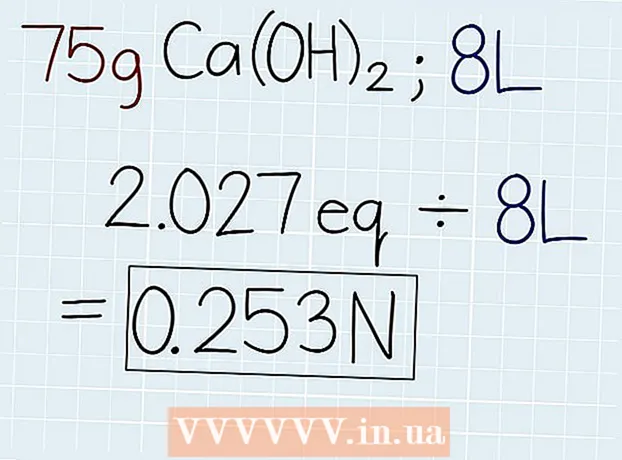
Innhold
- Trinn
- Metode 1 av 2: Beregning av normalitet via molaritet
- Metode 2 av 2: Beregning av normalitet i ekvivalent masse
- Tips
- Hva trenger du
Normalitet indikerer konsentrasjonen av syre eller alkali i en løsning. For å finne ut normaliteten til en løsning, kan både molaritet og molekylets ekvivalente masse brukes i beregningene. Hvis du velger å bruke molaritet, bruker du formelen N = M (n), hvor M er molaritet og n er antall hydrogen- eller hydroksydmolekyler. Hvis du bestemmer deg for å bruke ekvivalent masse, bruker du formelen N = eq ÷ V, hvor eq er antall ekvivalenter og V er volumet til løsningen.
Trinn
Metode 1 av 2: Beregning av normalitet via molaritet
 1 Tilsett molmassen til alle komponentene i løsningen. Finn elementene i den kjemiske formelen på det periodiske bordet for å finne ut atommassen deres, som tilsvarer molmassen. Skriv ned molarmassen til hvert element og multipliser det med antallet av disse elementene. Legg til molmassen til alle komponentene for å finne den totale molare massen.
1 Tilsett molmassen til alle komponentene i løsningen. Finn elementene i den kjemiske formelen på det periodiske bordet for å finne ut atommassen deres, som tilsvarer molmassen. Skriv ned molarmassen til hvert element og multipliser det med antallet av disse elementene. Legg til molmassen til alle komponentene for å finne den totale molare massen. - For eksempel, hvis du vil vite molarmassen av svovelsyre (H2SÅ4), finn ut molmassen av hydrogen (1 g), svovel (3 g) og oksygen (16 g).
- Multipliser massen med antall komponenter i sammensetningen. I vårt eksempel er det 2 hydrogenatomer og 4 oksygenatomer. Den totale molmassen av hydrogen er 2 x 1 g = 2 g. Molarmassen av oksygen i denne løsningen vil være 4 x 16 g = 64 g.
- Tilsett alle molarmassene. Du får 2 g + 32 g + 64 g = 98 g / mol.
- Hvis du allerede kjenner molariteten til løsningen du leter etter, går du direkte til trinn 4.
 2 Del den faktiske massen av løsningen med molmassen. Finn ut den faktiske vekten av løsningen. Det vil bli angitt enten på beholderen med løsningen, eller i selve oppgaven.Del deretter massen av løsningen med den totale molare massen som ble funnet tidligere. Resultatet vil være antall mol i løsningen, hvoretter "mol" skal skrives.
2 Del den faktiske massen av løsningen med molmassen. Finn ut den faktiske vekten av løsningen. Det vil bli angitt enten på beholderen med løsningen, eller i selve oppgaven.Del deretter massen av løsningen med den totale molare massen som ble funnet tidligere. Resultatet vil være antall mol i løsningen, hvoretter "mol" skal skrives. - For eksempel, hvis du prøver å finne ut normaliteten til 100 g H2SÅ4oppløst i 12 liter væske, bruk den faktiske massen og del med molar. Som et resultat får du: 100 g ÷ 98 g / mol = 1,02 mol.
- 1 mol er lik 6,02 x 10 atomer eller molekyler av en løsning.
 3 Del resultatet med volumet av løsningen i liter for å finne molariteten. Ta antall mol i løsningen som nettopp er beregnet, og del den med det totale volumet av løsningen som skal måles. Som et resultat vil du kjenne molariteten (M), som du kan finne ut konsentrasjonen av løsningen med.
3 Del resultatet med volumet av løsningen i liter for å finne molariteten. Ta antall mol i løsningen som nettopp er beregnet, og del den med det totale volumet av løsningen som skal måles. Som et resultat vil du kjenne molariteten (M), som du kan finne ut konsentrasjonen av løsningen med. - Basert på vårt eksempel får vi følgende formel: 1,02 mol ÷ 12 L = 0,085 M.
Råd: Sørg for å konvertere volumet av løsningen til liter, hvis du ikke allerede har gjort det. Ellers får du feil svar.
 4 Multipliser molaritet med antall hydrogen- eller hydroksydmolekyler. Ta en titt på den kjemiske formelen for å finne ut antall hydrogenatomer (H) i en syre eller hydroksydmolekyler i (OH) i basen. Multipliser deretter molariteten til løsningen med antallet hydrogen- eller hydroksydmolekyler i løsningen for å finne normal konsentrasjon eller normalitet. På slutten av svaret skriver du forkortelsen "N".
4 Multipliser molaritet med antall hydrogen- eller hydroksydmolekyler. Ta en titt på den kjemiske formelen for å finne ut antall hydrogenatomer (H) i en syre eller hydroksydmolekyler i (OH) i basen. Multipliser deretter molariteten til løsningen med antallet hydrogen- eller hydroksydmolekyler i løsningen for å finne normal konsentrasjon eller normalitet. På slutten av svaret skriver du forkortelsen "N". - I vårt eksempel er svovelsyre (H2SÅ4) 2 hydrogenatomer. Så formelen vil være slik: 0,085 M x 2 = 0,17 N.
- I et annet eksempel har natriumhydroksid (NaOH) med en molaritet på 2 M bare 1 hydroksydmolekyl. Derfor vil formelen være som følger: 2 M x 1 = 2 N.
Metode 2 av 2: Beregning av normalitet i ekvivalent masse
 1 Finn ut den totale molare massen av løsningen. Ta en titt på løsningens kjemiske formel og finn hvert element i det periodiske bordet. Skriv ned molarmassen til hvert element og multipliser det med antallet av elementene i formelen. Legg til alle molmassene for å finne den totale molare massen i gram.
1 Finn ut den totale molare massen av løsningen. Ta en titt på løsningens kjemiske formel og finn hvert element i det periodiske bordet. Skriv ned molarmassen til hvert element og multipliser det med antallet av elementene i formelen. Legg til alle molmassene for å finne den totale molare massen i gram. - For eksempel, hvis du vil vite molmassen til Ca (OH)2, finn deretter ut molmassen av kalsium (40 g), oksygen (16 g) og hydrogen (1 g).
- I formelen er det 2 atomer av oksygen og hydrogen. Den totale oksygenmassen vil være: 2 x 16 g = 32 g. Molens masse av hydrogen vil være: 2 x 1 g = 2 g.
- Tilsett alle molmassene for å få 40 g + 32 g + 2 g = 74 g / mol.
 2 Del molarmassen med antall hydrogen- eller hydroksydmolekyler. Finn ut antall hydrogenatomer (H) i en syre eller hydroksyd (OH) molekyler i basen. Del den totale molmassen akkurat oppnådd med antall atomer eller molekyler for å finne vekten til 1 ekvivalent, som vil være lik massen til 1 mol hydrogen eller hydroksid. På slutten av svaret skriver du forkortelsen "G.-e." som betyr massen til ekvivalenten.
2 Del molarmassen med antall hydrogen- eller hydroksydmolekyler. Finn ut antall hydrogenatomer (H) i en syre eller hydroksyd (OH) molekyler i basen. Del den totale molmassen akkurat oppnådd med antall atomer eller molekyler for å finne vekten til 1 ekvivalent, som vil være lik massen til 1 mol hydrogen eller hydroksid. På slutten av svaret skriver du forkortelsen "G.-e." som betyr massen til ekvivalenten. - I vårt eksempel er Ca (OH)2 2 to hydrogenmolekyler, noe som betyr at massen til ekvivalenten vil være lik 74 g / mol ÷ 2 = 37 G.-e.
 3 Del den faktiske vekten av løsningen med tilsvarende vekt. Når du kjenner massen til ekvivalenten, deler du den med massen av løsningen, som er angitt på beholderen med løsningen eller i problemet som skal løses. Svaret vil være antall ekvivalenter i løsningen, slik at du deretter kan beregne normaliteten. På slutten av svaret setter du forkortelsen "e".
3 Del den faktiske vekten av løsningen med tilsvarende vekt. Når du kjenner massen til ekvivalenten, deler du den med massen av løsningen, som er angitt på beholderen med løsningen eller i problemet som skal løses. Svaret vil være antall ekvivalenter i løsningen, slik at du deretter kan beregne normaliteten. På slutten av svaret setter du forkortelsen "e". - Hvis i vårt eksempel 75 g Ca (OH)2, da vil formelen være som følger: 75 g ÷ 37 G.-e = 2.027 Oe.
 4 Del antall ekvivalenter med volumet av løsning i liter. Finn ut det totale volumet av løsningen og skriv ned svaret i liter. Ta antallet ekvivalenter som nettopp er oppnådd, og del med volumet på løsningen for å finne ut normaliteten. På slutten av svaret setter du en forkortelse "N".
4 Del antall ekvivalenter med volumet av løsning i liter. Finn ut det totale volumet av løsningen og skriv ned svaret i liter. Ta antallet ekvivalenter som nettopp er oppnådd, og del med volumet på løsningen for å finne ut normaliteten. På slutten av svaret setter du en forkortelse "N". - Hvis det er 75 g Ca (OH) i en løsning med et volum på 8 liter2, divider deretter antall ekvivalenter med volumet på følgende måte: 2.027 Oe. ÷ 8 l = 0,253 N.
Tips
- Normal konsentrasjon, eller normalitet, brukes ofte til å måle syrer og baser. Hvis du trenger å bestemme konsentrasjonen av en annen løsning, gjøres dette vanligvis ved å måle molariteten.
Hva trenger du
- Periodiske tabell
- Kalkulator