Forfatter:
Louise Ward
Opprettelsesdato:
11 Februar 2021
Oppdater Dato:
1 Juli 2024

Innhold
Størrelsen på et atom er så liten at det er vanskelig å måle atomnummeret til en kjemisk forbindelse nøyaktig. For å være i stand til å måle en mengde stoffer nøyaktig, bruker forskere en molenhet for å representere et spesifisert antall atomer. Én mol stoff er definert som ekvivalent med antall karbonatomer inneholdt i 12 gram karbonisotop, som er omtrent 6.022 x 10 atomer. Denne verdien kalles Avogadro-nummeret, eller Avogadro-konstanten. Dette blir også referert til som antall atomer i 1 mol av et hvilket som helst element, og 1 mol av massen til et stoff kalles molmassen for det stoffet.
Fremgangsmåte
Metode 1 av 2: Beregn molarmassen til et element
Definisjon av molær masse. Molmasse av et stoff er massen (i gram) av en mol av stoffet. For å beregne molarmassen til et element, multipliser atommassen med gram-per-mol-konverteringsfaktoren (g / mol).
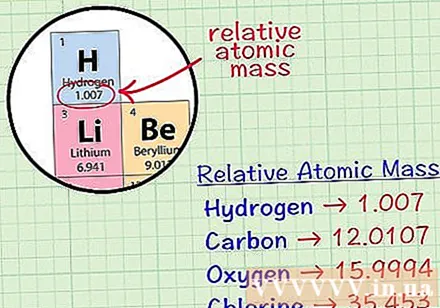
Finn det gjennomsnittlige kubiske atomet til et element. Det gjennomsnittlige masseatomet til et element er den gjennomsnittlige massen, i atomenheter, i en prøve som inkluderer alle isotopene til det elementet. Denne informasjonen er ofte gitt i det periodiske elementet. Ved å finne et element kan du finne et gjennomsnittlig kubikkatom skrevet rett under elementets kjemiske symbol. Denne verdien er ikke et helt tall, men et tall med desimaler.- For eksempel med hydrogen er det gjennomsnittlige masseatomet 1,007; Det gjennomsnittlige kubiske atom av karbon er 12.0107; Det gjennomsnittlige oksygenmassen er 15.9994; klor har en gjennomsnittlig atommasse på 35 453.

Multipliser det gjennomsnittlige masseatomet med molarmassekonstanten. Enheten for molar glid er definert som 0,001 kilo per mol, eller 1 gram per mol. Produktet av det gjennomsnittlige masseatomet og molmassekonstanten konverterer enheten av atommasse til gram per mol, så molarmassen av hydrogen vil være 1,007 gram per mol, karbon er 12. 0107 gram per mol oksygen er 15.9995 gram per mol og klor er 35.453 gram per mol.- Noen grunnstoffer eksisterer i naturen som molekyler som består av to eller flere av de samme atomer. Det vil si at hvis du vil beregne molmassen av forbindelser som består av mer enn ett atom, som hydrogengass, oksygengass eller klorgass, må du bestemme den gjennomsnittlige atommassen til forbindelsen og multiplisere denne verdien. med den molare massekonstanten, '' så '' multipliser du produktet du nettopp fant med 2.
- Med H2: 1.007 x 2 = 2.014 gram per mol; for O2: 15,9994 x 2 = 31,9988 gram per mol; og Cl2: 35 453 x 2 = 70 096 gram per mol.
Metode 2 av 2: Beregn molarmassen til forbindelsen

Bestem strukturformelen til forbindelsen. Stoffets strukturformel gir atomnummeret til hvert grunnstoff som utgjør den forbindelsen. (Denne informasjonen er tilgjengelig i alle referansebøker). For eksempel er den kjemiske formelen for saltsyre HCl; av glukose er C6H12O6. Med denne strukturformelen kan vi bestemme antallet av hver type atom som utgjør forbindelsen som blir vurdert.- Hvor HCl har ett hydrogenatom og ett kloratom.
- Glukosesukkermolekyl C6H12O6 har 6 karbonatomer, 12 hydrogenatomer og 6 oksygenatomer.
Bestem gjennomsnittlig masseatom for hvert bestanddel. Bruk det periodiske systemet for å finne gjennomsnittlig masseatom for hvert element som er tilstede i forbindelsen. Det gjennomsnittlige masseatomet skrives vanligvis under elementets kjemiske symbol på det periodiske systemet. I likhet med å beregne molarmassen til et element, multipliser det gjennomsnittlige masseatomet med 1 gram / mol.
- Det gjennomsnittlige masseatomet til elementene som utgjør saltsyre er som følger: hydrogen 1007 g / mol og klor 35 453 g / mol.
- Det gjennomsnittlige masseatomet til elementene som utgjør glukosemolekylet er: karbon, 12,017 g / mol; hydrogen, 1007 g / mol; og oksygen, 15,9995 g / mol.
Beregn molmassen til hvert komponentelement. Å multiplisere et elementets masseatom med antall atomer det bidrar i en forbindelse gir den gjennomsnittlige massen til elementet i forbindelsen.
- Når det gjelder saltsyre, saltsyre, er molmassen til elementet hydrogen 1.007 g / mol, og den for klor er 35.453 g / mol.
- I tilfelle glukose, C6H12O6, molmassen til hvert grunnstoff er som følger: karbon, 12,0107 x 6 = 72,0642 g / mol; hydrogen, 1007 x 12 = 12,084 g / mol; oksygen, 15.9995 x 6 = 95.9964 g / mol.
Total molær masse av bestanddelene. Den totale molare massen av komposteringselementene er molarmassen til forbindelsen.I det forrige trinnet beregnet vi molmassen til hvert element som er tilstede i forbindelsen. I dette trinnet trenger vi bare å legge alle disse verdiene sammen.
- Molmasse av saltsyre er 1.007 + 35.453 = 36.460 g / mol. 36,46 gram er massen av 1 mol saltsyre.
- Molarmasse glukose er 72,0642 + 12,084 + 95,9964 = 180,1446 g / mol. Så hver mol glukose har en masse på 180,14 gram.
Råd
- Selv om det gjennomsnittlige masseatomet i de fleste tilfeller er registrert til nærmeste 1 del 1000 (4 desimaler), reduseres molærmassen ofte i laboratorier til 2 desimaler i laboratorier, noen ganger enda mindre, for store molekyler. Derfor, i laboratorietilfelle, kan molarmassen av saltsyre skrives som 36,46 gram per mol, for glukose 180,14 gram per mol.
Hva trenger du
- Kjemisk referansebok eller periodisk grunnstoff
- Datamaskin